Перейти к:
Оценка токсичности и опасности 2,2-диметокси-2-фенилацетофенона
https://doi.org/10.47470/0016-9900-2025-104-12-1741-1748
EDN: luesxg
Аннотация
Введение. 2,2-диметокси-2-фенилацетофенон широко используется как фотоинициатор в различных областях, в том числе при производстве лаков, красок, стоматологических материалов и покрытий, однако его токсикологические свойства изучены недостаточно.
Цель исследования заключалась в изучении токсичности и опасности 2,2-диметокси-2-фенилацетофенона.
Материалы и методы. Проведены токсикологические исследования для изучения воздействия 2,2-диметокси-2-фенилацетофенона на организм теплокровных животных: оценка острой токсичности при пероральном, дермальном и ингаляционном путях поступления, кумулятивных свойств, раздражающего действия на слизистые оболочки глаз и неповреждённые кожные покровы, кожно-резорбтивного и сенсибилизирующего действия.
Результаты. Проведённые исследования показали, что 2,2-диметокси-2-фенилацетофенон относится к 4-му классу малоопасных веществ при пероральном поступлении (DL50 > 5000 мг/кг), в остром опыте при нанесении на кожу не вызвал гибели подопытных животных (DL50 для крыс > 2500 мг/кг). Вещество не обладает местным раздражающим действием на кожу, но способно вызывать раздражение слизистых оболочек глаз, не обладает кожно-резорбтивным действием, не является аллергеном и не обладает кумулятивными свойствами. 2,2-диметокси-2-фенилацетофенон характеризуется низкой летучестью, при изучении острой ингаляционной токсичности была достигнута его максимальная концентрация на уровне 500 мг/м³, следовательно, вещество можно отнести к умеренно опасным при ингаляционном поступлении.
Ограничения исследования. Из-за низкой летучести 2,2-диметокси-2-фенилацетофенона и технических возможностей ингаляционной установки исследование острой ингаляционной токсичности проводилось только при одной концентрации.
Заключение. Результаты проведённых токсикологических исследований позволили установить, что 2,2-диметокси-2-фенилацетофенон относится к веществам 3-го класса опасности (умеренно опасные). С учётом широкого применения, наличия вещества в промышленных выбросах предприятий и, следовательно, воздействия на население вблизи таких объектов рекомендовано дальнейшее изучение хронического действия, отдалённых эффектов и канцерогенного потенциала данного соединения.
Соблюдение этических стандартов. Исследование выполнено в соответствии с общепринятыми правилами этического обращения с лабораторными животными и одобрено комиссией по биоэтике ФГБУ «ЦСП» ФМБА России (выписка из протокола заседания комиссии от 18.09.2024 г. № 5).
Участие авторов:
Федотова Л.А. – концепция и дизайн исследования, редактирование;
Мамонов Р.А. – концепция и дизайн исследования, редактирование;
Печникова И.А. – концепция и дизайн исследования, сбор и обработка материала;
Лебедь-Шарлевич Я.И. – сбор и обработка материала, анализ полученных данных, написание текста;
Манаева Е.С. – сбор и обработка материала, анализ полученных данных, написание текста;
Потапченко Т.Д. – сбор и обработка материала, анализ полученных данных, написание текста;
Беляева Н.И. – сбор и обработка материала;
Голландцева А.И. – сбор и обработка материала;
Немцева Ю.С. – сбор и обработка материала;
Тюрина И.А. – сбор и обработка материала;
Федорцова Д.Ю. – сбор и обработка материала;
Федорцов И.А. – сбор и обработка материала;
Болехан В.Н. – редактирование.
Все соавторы – утверждение окончательного варианта статьи, ответственность за целостность всех её частей.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Финансирование. Исследование не имело финансовой поддержки.
Поступила: 22.04.2025 / Поступила после доработки: 06.08.2025 / Принята к печати: 02.12.2025 / Опубликована: 15.01.2026
Ключевые слова
Для цитирования:
Федотова Л.А., Мамонов Р.А., Печникова И.А., Лебедь-Шарлевич Я.И., Манаева Е.С., Потапченко Т.Д., Беляева Н.И., Голландцева А.И., Немцева Ю.С., Тюрина И.А., Федорцова Д.Ю., Федорцов И.А., Болехан В.Н. Оценка токсичности и опасности 2,2-диметокси-2-фенилацетофенона. Гигиена и санитария. 2025;104(12):1741-1748. https://doi.org/10.47470/0016-9900-2025-104-12-1741-1748. EDN: luesxg
For citation:
Fedotova L.A., Mamonov R.A., Pechnikova I.A., Lebed-Sharlevich Ya.I., Manaeva E.S., Potapchenko T.D., Belyaeva N.I., Gollandtseva A.I., Nemtseva Yu.S., Tyurina I.A., Fedortsova D.Yu., Fedortsov I.A., Bolekhan V.N. Assessment of 2,2-dimethoxy-2-phenylacetophenone toxicity and hazard. Hygiene and Sanitation. 2025;104(12):1741-1748. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1741-1748. EDN: luesxg
Введение
Ежегодно в мире синтезируется несколько тысяч новых химических веществ, которые находят применение в различных сферах деятельности человека. Однако большая часть этих соединений остаётся слабо изученной с точки зрения их токсичности и потенциальной опасности для здоровья населения, не имеет гигиенических нормативов содержания в различных средах, что затрудняет оценку их действия на человека, особенно при комплексном и комбинированном действии [1]. Токсикологические исследования и научное обоснование гигиенических нормативов химических веществ и их смесей много лет являются одним из важнейших направлений работы Научно-исследовательского института экологии человека и гигиены окружающей среды им. А.Н. Сысина – ныне ФГБУ «ЦСП» ФМБА России [2, 3].
Одно из веществ, имеющих широкое применение, но недостаточно исследованных в отношении токсичности, – 2,2-диметокси-2-фенилацетофенон (2,2-ДМФАФ). Это соединение относится к группе ароматических кетонов и является производным бензофенона [4]. 2,2-диметокси-2-фенилацетофенон применяется в различных областях промышленности в качестве фотоинициатора. При облучении ультрафиолетовым излучением (~ 350–400 нм) вещество разлагается с образованием свободных радикалов, которые инициируют радикальную полимеризацию [5]. Особенно широко 2,2-ДМФАФ используется при УФ-отверждении акрилатов и метакрилатов. Благодаря этому он находит применение в таких областях, как производство лаков и красок (в том числе типографских), фотополимерных смол для 3D-печати, стоматологических материалов и покрытий [6–8].
Исследования указывают на то, что некоторые фотоинициаторы могут вызывать цитотоксические эффекты, а также раздражение и сенсибилизацию кожи. Например, 2-метил-4′-(метилтио)-2-морфолинопропиофенон и 1-гидроксициклогексилфенилкетон вызывали цитотоксичность в нормальных периферических мононуклеарных клетках крови человека [9, 10]. Также установлено, что включение бензофенона, структурно схожего с 2,2-ДМФАФ и используемого в качестве фотоинициатора в составе солнцезащитных кремов, может вызывать аллергические кожные реакции [11], аналогичные тем, которые вызывают другие кожные раздражители (фотоаллергические реакции, аллергический контактный дерматит [12] и эритема лица [13]).
В научной литературе сведения о токсичности и опасности 2,2-диметокси-2-фенилацетофенона представлены недостаточно. Полулетальная доза DL50 при внутрижелудочном введении вещества белым крысам установлена на уровне 1470 мг/кг [14]. При аппликации 2,2-ДМФАФ на неповреждённые кожные покровы крыс значение DL50 превысило уровень в 7000 мг/кг [15]. Известно, что вещество может оказывать раздражающее действие (в том числе на слизистые оболочки глаз) и респираторную сенсибилизацию, вызывает фотосенсибилизацию с аллергическими реакциями на свет – от реакций, подобных солнечным ожогам, до отёчных, пузырьковых поражений или булл. При длительном контакте 2,2-ДМФАФ может провоцировать фотоаллергический контактный дерматит, сенсибилизирующее действие вещества не выявлено [16]. Исследования на клеточных культурах показали цитотоксичность 2,2-диметокси-2-фенилацетофенон в отношении нормальных эмбриональных фибробластов лёгких человека, которая усиливается при комбинированном действии с растворителем красок 1,2-дихлорпропаном, что повышает риск развития болезней органов дыхания у работников полиграфической промышленности [17].
В настоящее время в России для 2,2-диметокси-2-фенилацетофенона установлен только ориентировочно допустимый уровень (ОДУ) в воде водных объектов, равный 0,5 мг/л (3-й класс опасности), лимитирующий показатель вредности – органолептический (запах). Гигиенические нормативы для воздуха рабочей зоны, атмосферного воздуха городских и сельских поселений не утверждены¹.
В связи с этим цель данного исследования заключалась в изучении токсичности и опасности 2,2-диметокси-2-фенилацетофенона.
Материалы и методы
По физико-химическим свойствам 2,2-диметокси-2-фенилацетофенон (химическая формула С16Н16О3, № CAS: 24650-42-8) представляет собой белый кристаллический порошок без запаха с молекулярной массой 256,3 г/моль, плотностью 1,132 г/см³. Температура плавления С16Н16О3 – плюс 67–70 °С, температура кипения – 100–115 °C при давлении менее 0,1 гПа [15].
Токсикологические исследования 2,2-диметокси-2-фенил-ацетофенона проводили в соответствии с действующими нормативно-методическими документами²,³,⁴,⁵ на белых крысах породы Sprague Dawley (масса тела 148–426 г), морских свинках-альбиносах (масса тела 300–350 г), белых мышах (масса тела 18–20 г), кроликах породы советская шиншилла (масса тела 3–3,5 кг). Нелинейные крысы, морские свинки-альбиносы, белые мыши были получены из филиала «Столбовая» ФГБУН НЦБМТ ФМБА России. Кролики породы советская шиншилла получены из филиала «Электрогорский» ФГБУН НЦБМТ ФМБА России. Животных подопытных и контрольных групп содержали на стандартном рационе вивария в соответствии с РД-АПК 3.10.07.02–09⁶.
Экспериментальные исследования включали оценку острой токсичности при пероральном, дермальном и ингаляционном путях поступления, изучение кумулятивных свойств, определение раздражающего действия на слизистые оболочки глаз, местного раздражающего действия на кожные покровы, кожно-резорбтивного и сенсибилизирующего действий на экспериментальных животных. Количественная характеристика методов и объёма исследований представлена в табл. 1.
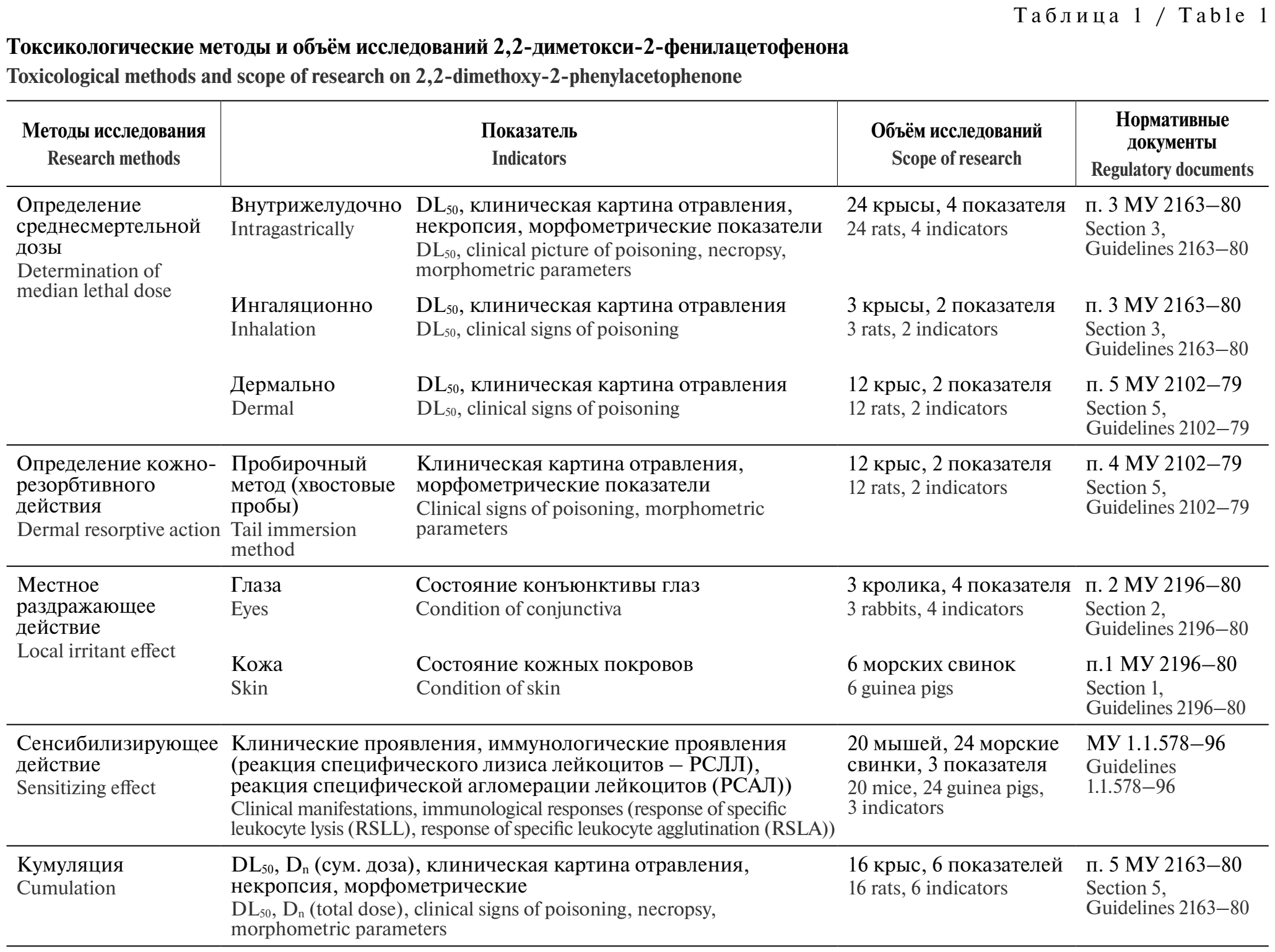
Для оценки острой токсичности 2,2-диметокси-2-фенил-ацетофенона при внутрижелудочном поступлении вещество разводили в растительном масле (в связи с плохой растворимостью в физиологическом растворе) и вводили животным через специальный зонд в дозах 1000; 3000 и 5000 мг/кг. Определение острой ингаляционной токсичности (в условиях четырёхчасового динамического воздействия) проводили в специализированной ингаляционной системе экспонирования «голова – нос» с контролем концентрации вещества в режиме реального времени. В рамках эксперимента была испытана концентрация на уровне 500 мг/м³. Для оценки острой дермальной токсичности исследуемое вещество наносили однократно на выстриженный участок кожи на спине животных в дозе 2600 мг/кг, время экспозиции – 4 ч. По окончании экспозиции остатки вещества смывали тёплой водой с мылом.
Изучение кожно-резорбтивного действия проводили на крысах пробирочным методом (хвостовые пробы). Хвосты подопытных животных на 2/3 длины погружали в 25%-ю взвесь вещества в 2%-м крахмальном геле на четыре часа ежедневно в течение четырёх недель, хвосты контрольных животных погружали в 2%-й крахмальный гель. По окончании опыта за животными продолжали наблюдение в течение двух недель. Во время эксперимента регистрировали общее состояние животных (внешний вид, поведение, пищевая активность, динамика массы тела). Эти показатели позволили оценить возможные последствия поступления вещества в организм через кожу.
Для оценки местного раздражающего действия на слизистые оболочки глаз 2,2-диметокси-2-фенилацетофенон вносили в конъюнктивальный мешок левого глаза кроликам в нативном виде в количестве 10 мг без смывания. Контролем служил правый глаз.
Местное раздражающее действие на неповреждённые кожные покровы оценивали после однократной аппликации на участок кожи размером 5 × 5 см на правом боку морских свинок (20 мг/см²). Контролем служил симметрично расположенный участок на левой стороне. После четырёхчасовой экспозиции вещество смывали тёплой водой с мылом.
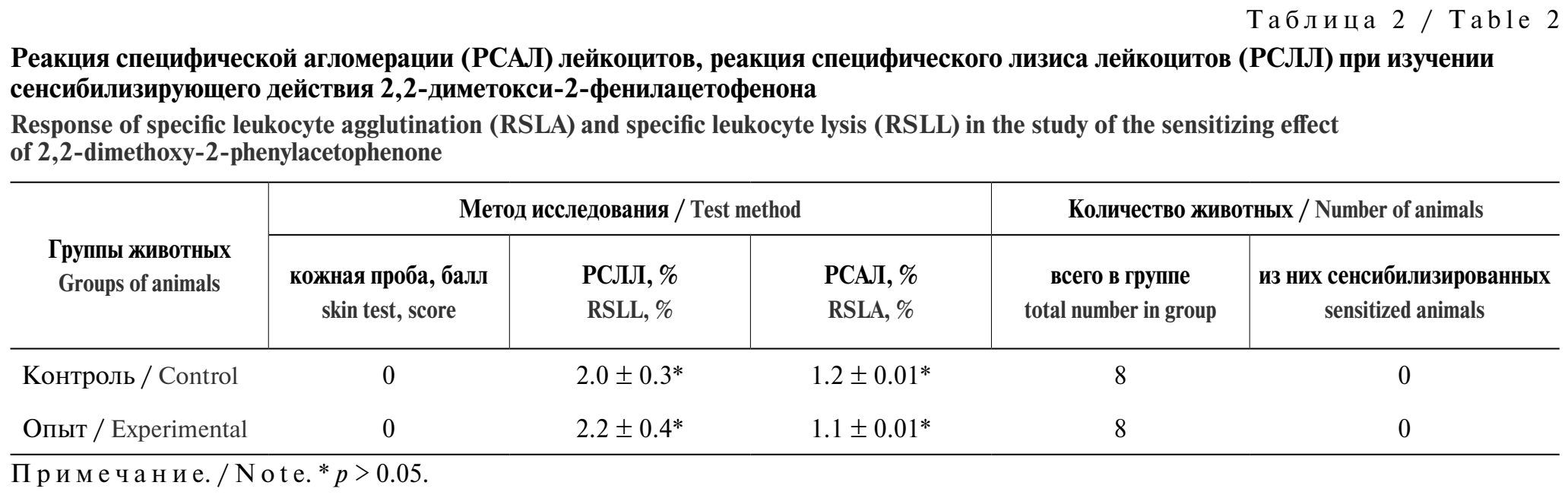
Способность 2,2-диметокси-2-фенилацетофенона вызывать сенсибилизацию организма оценивали с помощью реакции гиперчувствительности замедленного типа (ГЗТ) на мышах, а также на морских свинках методом внутрикожной сенсибилизации. Белым мышам однократно вводили внутрикожно в основание хвоста 100 мкг вещества, эмульгированного в 60 мкл смеси полного адъюванта Фрейнда и раствора Хэнкса. Сенсибилизацию определяли через 5 сут путём введения 100 мкг вещества в растворе Хэнкса в подушечку задней лапы, оценивая реакцию по величине отёка у экспериментальных и контрольных животных. Исследование на морских свинках начинали с однократной сенсибилизации, для чего в кожу наружной поверхности уха вводили 50 и 200 мкг вещества, разведённого в 0,1 мл раствора Хэнкса. Через 8 дней проводили тестирование путём постановки кожных тестов. Через 24 ч после этого отбирали кровь для иммунологических тестов – реакции специфического лизиса лейкоцитов (РСЛЛ) и реакции специфической агломерации (РСАЛ) лейкоцитов.
Кумулятивные свойства 2,2-диметокси-2-фенилацето-фенона изучали на крысах по методу Lim et al. (метод Лима⁷). В течение 24 дней животным ежедневно внутрижелудочно вводили вещество с постепенным увеличением дозы: через каждые 4 дня – в 1,5 раза.
Результаты экспериментов обрабатывали статистически, достоверность различий между группами определяли с помощью t-критерия Стьюдента и непараметрических методов статистики. Различия между опытными и контрольными группами считались значимыми при р ≤ 0,05. Расчёт DL50 проводили методом наименьших квадратов пробит-анализа кривых летальности по Прозоровскому [18].
Результаты
Проведённый эксперимент по изучению острой токсичности 2,2-диметокси-2-фенилацетофенона при внутрижелудочном поступлении показал, что при дозе 1000 мг/кг отсутствовали случаи гибели подопытных животных, выраженных симптомов интоксикации не было. Пищевое поведение и общее состояние животных не отличалось от животных контрольной группы как в первые часы после введения вещества, так и на протяжении всего периода наблюдений. Доза 3000 мг/кг также не вызывала гибели животных, однако сразу после введения вещества подопытные животные демонстрировали кратковременное угнетение (лежачее положение, сниженная реакция на внешние раздражители), которое исчезло в течение первых суток наблюдения. При введении дозы 5000 мг/кг наблюдались схожие эффекты, которые носили более выраженный характер, чем при дозе 3000 мг/кг, но на вторые сутки наблюдений признаки интоксикации у подопытных животных отсутствовали. Ни в одной из экспериментальных групп за весь постэкспозиционный период (14 дней) случаев гибели животных зафиксировано не было.
Таким образом, в процессе эксперимента опытным путём установлена величина DL0 (максимальная переносимая доза). Величина DL50 при введении в желудок 2,2-диметокси-2-фенилацетофенона в соответствии с методом наименьших квадратов пробит-анализа кривых летальности составит > 5000 мг/кг.
При определении острой ингаляционной токсичности 2,2-диметокси-2-фенилацетофенона (концентрация 500 мг/м³) в условиях четырёхчасовой динамической экспозиции летальные исходы у подопытных животных не зафиксированы. Поведение и общее состояние животных экспериментальной группы не отличалось от контрольной группы. Несмотря на временное снижение активности после окончания воздействия, признаки интоксикации у подопытных животных исчезли в течение первых двух часов.
После однократного нанесения вещества на кожные покровы в дозе 2600 мг/кг вещество не вызывало гибели подопытных животных и признаков интоксикации в течение 14-дневного наблюдения. Согласно полученным результатам, при однократном контакте с кожей 2,2-диметокси-2-фенилацетофенон не вызывает острого токсического действия (DL50 > 2500 мг/кг).
Оценка кожно-резорбтивного действия показала отсутствие способности вещества к резорбции через кожные покровы в пробирочном тесте (хвостовые пробы) на крысах в период эксперимента. У подопытных животных не отмечено видимых признаков интоксикации, изменений общего состояния и поведения, а также явлений раздражения на коже хвостов.
Вещество обладает слабым раздражающим действием на слизистую оболочку глаза. После внесения вещества в конъюнктивальный мешок глаз кроликов у всех животных наблюдалась слабая гиперемия конъюнктивы, которая проходила на вторые сутки наблюдения. Других признаков проявления раздражающего действия на глазные оболочки отмечено не было.
Исследования показали, что 2,2-диметокси-2-фенил-ацетофенон не оказывает местного раздражающего действия на неповреждённые кожные покровы при однократной аппликации. У подопытных животных не наблюдалось признаков раздражения ни сразу после нанесения вещества, ни через час, ни в течение 14-дневного периода наблюдения.
Также установлено, что данное соединение не обладает сенсибилизирующим действием. Реакция гиперчувствительности замедленного типа, исследованная на мышах по величине отёка после повторного введения вещества, не выявила статистически значимых различий между экспериментальной и контрольной группами (p > 0,05). Через 24 ч отёк составил 0,078 ± 0,01 мм в экспериментальной группе и 0,082 ± 0,01 мм в контрольной, что свидетельствует об отсутствии сенсибилизации. Способность 2,2-диметокси-2-фенилацетофенона вызывать сенсибилизацию организма оценивалась и при помощи внутрикожной сенсибилизации морских свинок. Положительная кожная проба не была зафиксирована ни у одного из животных. Показатели РСЛЛ и РСАЛ у всех животных не превышали 10%. Статистически значимых различий среднегрупповых показателей не было (p > 0,05). Результаты реакции специфической агломерации лейкоцитов (РСАЛ) и реакции специфического лизиса лейкоцитов (РСЛЛ) у животных опытной группы не имели статистически значимого отклонения от контрольной группы (табл. 2). Полученные данные свидетельствуют о том, что данное вещество не является аллергеном.
Кумулятивные свойства 2,2-диметокси-2-фенилацето-фенона исследовали на крысах по методу Лима⁷ с ежедневным внутрижелудочным введением вещества и постепенным увеличением дозы. Исходно для перорального введения планировалась доза, равная 1/10 от установленной DL50 (500 мг/кг), однако из-за низкой растворимости вещества начальная доза была снижена до 150 мг/кг. В ходе эксперимента не зафиксировано случаев гибели или значимых клинических проявлений токсичности, а динамика массы тела экспериментальных животных не отличалась от контрольной группы. Некропсия по окончании исследования не выявила существенных изменений во внешнем виде и массе органов.
Обсуждение
Полученные результаты свидетельствуют о низкой острой токсичности 2,2-диметокси-2-фенилацетофенона при пероральном и кожном воздействии. При внутрижелудочном введении значение DL50 превышает 5000 мг/кг, что, согласно ГОСТ 12.1.007–76⁸, позволяет отнести вещество к 4-му классу (малоопасные вещества). При нанесении на кожные покровы средняя смертельная доза составляет более 2500 мг/кг, что также соответствует 4-му классу опасности.
Острую ингаляционную токсичность 2,2-диметокси-2-фенилацетофенона оценивали в четырёхчасовой динамической экспозиции при концентрации 500 мг/м³. Доза определена как максимальная достижимая вследствие физико-химических свойств исследуемого вещества и технических возможностей ингаляционной системы. Согласно нормативным документам⁸, эта концентрация соответствует второму классу опасности, однако физико-химические характеристики вещества свидетельствуют о его низкой летучести и высокой термической стабильности. При температуре плюс 25 °C упругость пара составляет всего 0,002 Па (в то время как для воды этот показатель ≈ 3168 Па), относительная плотность равна 1,1, температура вспышки – плюс 163 °C, а температура самовоспламенения – плюс 400 °C [14]. Данные подтверждают, что вещество находится в стабильном твёрдом состоянии при нормальных условиях и переходит в газообразную фазу лишь при значительном нагревании. Таким образом, вероятность образования токсичных аэрозолей и паров в обычных условиях крайне мала. Это объясняет низкую ингаляционную токсичность 2,2-диметокси-2-фенилацетофенона, которая была установлена в проведённом эксперименте. Таким образом, данное вещество можно отнести к 3-му классу опасности при ингаляционном поступлении.
Слабая проницаемость вещества через кожные покровы подтверждается отсутствием системного токсического эффекта (кожно-резорбтивного действия). Раздражающее действие ограничено слабой, обратимой гиперемией слизистой оболочки глаза, признаки повреждающего действия отсутствовали. Раздражающего эффекта при кожной аппликации не наблюдали, что согласуется с данными, полученными в предыдущих работах [15, 16].
Проведённая оценка кумулятивных свойств также указывает на низкий риск накопления токсического действия при повторных экспозициях. Следует отметить, что вследствие низкой растворимости вещества было выполнено 20 введений (максимальная достижимая доза) 2,2-диметокси-2-фенилацетофенона. Суммарная доза (Dn), полученная каждым экспериментальным животным, составила при ежедневном введении 7912 мг/кг. Сопоставление величины суммарной дозы и DL50 показывает, что животными за время эксперимента было получено в 1,5 раза больше 2,2-диметокси-2-фенилацетофенона, чем количество, которое вызывает 50%-ю гибель при однократном введении (Dn/DL50 = 7912/1500 = 5,2). Коэффициент кумуляции (Ккум) равен 5,2. Как было указано выше, из-за низкой растворимости вещества нами была выбрана начальная доза 150 мг/кг, что соответствует величине DL50 = 1500 мг/кг. Определение среднесмертельной дозы при однократном поступлении в желудок не выявило случаев гибели подопытных животных при введении доз 1000; 3000 и 5000 мг/кг, поэтому исследование по определению кумулятивного действия не противоречит тому, что величина DL50 при внутрижелудочном введении составляет > 5000 мг/кг. Таким образом, 2,2-диметокси-2-фенилацетофенон может быть отнесён к веществам, не обладающим кумулятивными свойствами.
В соответствии с «Методическими указаниями по установлению ориентировочных безопасных уровней воздействия (ОБУВ) загрязняющих веществ в атмосферном воздухе населённых мест»⁹ обоснование ОБУВ 2,2-диметокси-2-фенилацетофенона в атмосферном воздухе населённых мест проводили с использованием собственных экспериментальных данных по установленным параметрам токсикометрии путём прогноза по формулам (табл. 3).

Полученные прогнозируемые величины ОБУВ для 2,2-диметокси-2-фенилацетофенона находятся в диапазоне от 0,06 до 0,35 мг/м³. Данные формулы учитывают класс опасности соединений: по результатам проведённых исследований параметры токсикометрии соответствуют 3-му классу опасности (умеренно опасные вещества), следовательно, согласно расчёту среднего арифметического для 2,2-диметокси-2-фенилацетофенона, прогнозная величина ОБУВ составит 0,2 мг/м³ в атмосферном воздухе городских и сельских поселений¹⁰.
Заключение
Проведённые токсикологические исследования по определению параметров острой токсичности позволили установить следующее. По величине среднесмертельной дозы при однократном введении в желудок (DL50 для крыс > 5000 мг/кг) 2,2-диметокси-2-фенилацетофенон относится к 4-му классу (малоопасные вещества) по степени воздействия на организм; при однократном нанесении на кожные покровы морских свинок вещество не обладает раздражающим действием; при однократном внесении в конъюнктивальный мешок кроликов в нативном виде обладает слабым раздражающим действием на слизистые оболочки глаза; в остром опыте при нанесении на кожу не вызывает гибели (DL50 для крыс > 2500 мг/кг) подопытных животных. Отсутствует способность вещества к резорбции через кожные покровы в пробирочном тесте (хвостовые пробы) на крысах в период эксперимента. При использовании метода с воспроизведением ГЗТ на белых беспородных мышах, а также на морских свинках методом внутрикожной сенсибилизации установлено, что 2,2-диметокси-2-фенилацетофенон не является аллергеном. Вещество не обладает кумулятивными свойствами. При изучении острой ингаляционной токсичности была достигнута концентрация 500 мг/м³, однако данное вещество обладает очень низкой летучестью, вследствие чего является умеренно опасным при ингаляционном пути поступления.
Таким образом, результаты проведённых токсикологических исследований позволили установить, что 2,2-диметокси-2-фенилацетофенон относится к веществам 3-го класса опасности (умеренно опасные). Рекомендованная величина ОБУВ в атмосферном воздухе городских и сельских поселений составляет 0,2 мг/м³. Однако с учётом широкого применения 2,2-ДМФАФ, поступления его в атмосферный воздух из источников выбросов предприятий и возможного воздействия на население, проживающее вблизи таких объектов, рекомендованы дальнейшие исследования, направленные на оценку возможного хронического действия, отдалённых эффектов и канцерогенного потенциала данного соединения.
¹ СанПиН 1.2.3685–21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания» (утв. Постановлением Главного государственного санитарного врача РФ от 28.01.2021 г. №2). URL: https://docs.cntd.ru/document/573500115
² МУ 2102–79. Оценка воздействия вредных химических соединений на кожные покровы и обоснование предельно допустимых уровней загрязнений кожи (Методические указания). Утверждены заместителем Главного государственного санитарного врача СССР А.И. Заиченко 1 ноября 1979 г. № 2102-79. URL: https://docs.cntd.ru/document/1200062476
³ МУ 1.1.578–96. Требования к постановке экспериментальных исследований по обоснованию предельно допустимых концентраций промышленных химических аллергенов в воздухе рабочей зоны и атмосферы. Методические указания. Утверждены первым заместителем Председателя Госкомсанэпиднадзора России – заместителем Главного государственного санитарного врача Российской Федерации С.В. Семеновым 21 октября 1996 г. URL: https://docs.cntd.ru/document/1200046685
⁴ МУ 2196–80. Методические указания к постановке исследований по изучению раздражающих свойств и обоснованию предельно допустимых концентраций избирательно действующих раздражающих веществ в воздухе рабочей зоны. Утверждены заместителем Главного государственного санитарного врача СССР А.И. Заиченко 11 августа 1980 г. № 2196-80. URL: https://docs.cntd.ru/document/1200076305
⁵ МУ 2163–80. Методические указания к постановке исследований для обоснования санитарных стандартов вредных веществ в воздухе рабочей зоны. Методические указания. Утверждены Главным государственным санитарным врачом СССР П.Н. Бургасовым 4 апреля 1980 г. URL: https://docs.cntd.ru/document/1200076306
⁶ РД-АПК 3.10.07.02–09. Рекомендательные документы. Методические рекомендации по содержанию лабораторных животных в вивариях научно-исследовательских институтов и учебных заведений. Утверждены и введены в действие заместителем министра сельского хозяйства Российской Федерации Л.И. Беляевым 1 декабря 2009 г. URL: https://docs.cntd.ru/document/1200088317
⁷ Lim R.K., Rink K.G., Glass H.G., Soaje-Echague E.A method for the evaluation of cumulation and tolerance by the determination of acute and subchronic median effective doses. Arch. Int. Pharmacodyn. Ther. 1961. 130, Mar 1: 336-53.
⁸ ГОСТ 12.1.007–76. Межгосударственный стандарт. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности. Утверждён и введён в действие Постановлением Государственного комитета СССР по стандартам от 10.03.1976 г. №579. URL: https://docs.cntd.ru/document/5200233
⁹ МУ 2630–82. Методические указания по установлению ориентировочных безопасных уровней воздействия (ОБУВ) загрязняющих веществ в атмосферном воздухе населённых мест. Утверждены заместителем Главного государственного санитарного врача СССР 25 ноября 1982 г. URL: https://docs.cntd.ru/document/675400120
¹⁰ ГН 1.1.701–98 «Гигиенические критерии для обоснования необходимости разработки ПДК и ОБУВ (ОДУ) вредных веществ в воздухе рабочей зоны, атмосферном воздухе населённых мест, воде водных объектов». Минздрав России. М., 1998.
Список литературы
1. Юдин С.М., ред. На страже защиты объектов среды и здоровья населения. М.: Квант Медиа; 2024. https://elibrary.ru/rpiyyq
2. Мамонов Р.А., Лебедь-Шарлевич Я.И., Манаева Е.С., Печникова И.А., Синицына О.О. Гигиеническое нормирование вредных химических веществ в воде – взгляд через призму исследований Научно-исследовательского института им. А.Н. Сысина. Гигиена и санитария. 2024; 103(10): 1261–72. https://doi.org/10.47470/0016-9900-2024-103-10-1261-1272 https://elibrary.ru/vsyubw
3. Федотова Л.А., Потапченко Т.Д. История становления гигиены атмосферного воздуха в исторических вехах и лицах Института им. А.Н. Сысина. Гигиена и санитария. 2024; 103(10): 1257–60. https://doi.org/10.47470/0016-9900-2024-103-10-1257-1260 https://elibrary.ru/npbvtd
4. Лазарев Н.В., Левина Э.Н. Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Том I. Органические вещества. Ленинград: Химия; 1976.
5. Kurdikar D.L., Peppas N.A. Method of determination of initiator efficiency: application to UV polymerizations using 2, 2-dimethoxy-2-phenylacetophenone. Macromolecules. 1994; 27(3): 733–8. https://doi.org/10.1021/ma00081a017
6. Mucci V., Vallo C. Efficiency of 2, 2-dimethoxy-2-phenylacetophenone for the photopolymerization of methacrylate monomers in thick sections. J. Appl. Polym. Sci. 2012; 123(1): 418–25. https://doi.org/10.1002/app.34473
7. Семчиков Ю.Д., Кашаев С.Ю., Тихонова А., Копылова Н.А., Голубев А.А., Ерегина Н.В. Влияние концентрации инициатора при трехмерной полимеризации акриловых олигомеров. Высокомолекулярные соединения. Серия Б. 1992; 34(2): 3–6.
8. Внук В.В., Ипполитов Е.В., Камаев С.В., Марков М.А., Новиков М.М., Черебыло С.А. Исследование процесса лазерной фотополимеризации композитных материалов на основе метакриловых олигомеров и порошка кремния. Химическая физика. 2020; 39(9): 88–93. https://doi.org/10.31857/S0207401X20090137 https://elibrary.ru/qcrlbd
9. Kawasaki Y., Yamaji K., Matsunaga H., Sendo T. Cytotoxicity of the polymerization agent, 2-methyl-4’-(methylthio)-2-morpholinopropiophenone on human monocytes. Biol. Pharm. Bull. 2012; 35(2): 256–9. https://doi.org/10.1248/bpb.35.256
10. Yamaji K., Kawasaki Y., Yoshitome K., Matsunaga H., Sendo T. Quantitation and human monocyte cytotoxicity of the polymerization agent 1-hydroxycyclohexyl phenyl ketone (Irgacure 184) from three brands of aqueous injection solution. Biol. Pharm. Bull. 2012; 35(10): 1821–5. https://doi.org/10.1248/bpb.b12-00210
11. Cook N., Freeman S. Report of 19 cases of photoallergic contact dermatitis to sunscreens seen at the Skin and Cancer Foundation. Australas J. Dermatol. 2001; 42(4): 257–9. https://doi.org/10.1046/j.1440-0960.2001.00531.x
12. Alanko K., Jolanki R., Estlander T., Kanerva L. Occupational allergic contact dermatitis from benzophenone-4 in hair-care products. Contact Dermatitis. 2001; 44(3): 188. https://doi.org/10.1034/j.1600-0536.2001.440308-9.x
13. Nedorost S.T. Facial erythema as a result of benzophenone allergy. J. Am. Acad. Dermatol. 2003; 49(5 Suppl.): S259–61. https://doi.org/10.1016/s0190-9622(03)00440-7
14. ECHA. European chemical agency data base. 2,2-Dimethoxy-1,2-diphenylethan-1-one. Available at: https://echa.europa.eu/da/registration-dossier/-/registered-dossier/5410/
15. Safety data sheet of the 2,2-Dimethoxy-2-phenylacetophenone according to Regulation (EC) No. 1907/2006. Version 7.3. Sigma Aldrich. Revision Date 12.09.2022. Available at: https://sigmaaldrich.cn/RU/en/sds/aldrich/196118?userType=undefined
16. Information on Hazardous Chemicals and Occupational Diseases. 2,2-Dimethoxy-2-phenylacetophenone. Available at: https://haz-map.com/Agents/19435
17. Kawasaki Y., Tsuboi C., Yagi K., Morizane M., Masaoka Y., Esumi S., et al. Photoinitiators enhanced 1,2-dichloropropane-induced cytotoxicity in human normal embryonic lung fibroblasts cells in vitro. Environ. Sci. Pollut. Res. Int. 2015; 22(6): 4763–70. https://doi.org/10.1007/s11356-014-3939-8
18. Прозоровский В.В. Использование метода наименьших квадратов пробит-анализа кривых летальности. Фармакология и токсикология. 1962; 25(1): 115–9. https://elibrary.ru/zcogzr
Об авторах
Лионэлла Айдыновна ФедотоваРоссия
Канд. мед. наук, вед. науч. сотр. ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: LFedotova@cspfmba.ru
Роман Александрович Мамонов
Россия
Канд. мед. наук, начальник отд., ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: RMamonov@cspfmba.ru
Ирина Александровна Печникова
Россия
Канд. мед. наук, вед. науч. сотр. ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: IPechnikova@cspfmba.ru
Яна Ивановна Лебедь-Шарлевич
Россия
Канд. биол. наук, ст. науч. сотр. ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: YaSharlevich@cspfmba.ru
Елизавета Сергеевна Манаева
Россия
Канд. биол. наук, ст. науч. сотр. ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: EManaeva@cspfmba.ru
Тимур Дмитриевич Потапченко
Россия
Канд. техн. наук, науч. сотр., ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: TPotapchenko@cspfmba.ru
Надежда Игоревна Беляева
Россия
Канд. биол. наук, вед. биолог, ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: NBelyaeva@cspfmba.ru
Александра Игоревна Голландцева
Россия
Химик, ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: AGollandtseva@cspfmba.ru
Юлия Сергеевна Немцева
Россия
Биолог, ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: IUNemtseva@cspfmba.ru
Ирина Алексеевна Тюрина
Россия
Биолог, ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: ITurina@cspfmba.ru
Дарья Юрьевна Федорцова
Россия
Биолог, ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: DFedortsova@cspfmba.ru
Илья Анатольевич Федорцов
Россия
Лаборант, ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: IFedortsov@cspfmba.ru
Василий Николаевич Болехан
Россия
Доктор мед. наук, доцент, директор ФИАЦ ММБР ФМБА России, ФГБУ "ЦСП" ФМБА России, 119121, Москва, Россия
e-mail: vbolekhan@cspfmba.ru
Рецензия
Для цитирования:
Федотова Л.А., Мамонов Р.А., Печникова И.А., Лебедь-Шарлевич Я.И., Манаева Е.С., Потапченко Т.Д., Беляева Н.И., Голландцева А.И., Немцева Ю.С., Тюрина И.А., Федорцова Д.Ю., Федорцов И.А., Болехан В.Н. Оценка токсичности и опасности 2,2-диметокси-2-фенилацетофенона. Гигиена и санитария. 2025;104(12):1741-1748. https://doi.org/10.47470/0016-9900-2025-104-12-1741-1748. EDN: luesxg
For citation:
Fedotova L.A., Mamonov R.A., Pechnikova I.A., Lebed-Sharlevich Ya.I., Manaeva E.S., Potapchenko T.D., Belyaeva N.I., Gollandtseva A.I., Nemtseva Yu.S., Tyurina I.A., Fedortsova D.Yu., Fedortsov I.A., Bolekhan V.N. Assessment of 2,2-dimethoxy-2-phenylacetophenone toxicity and hazard. Hygiene and Sanitation. 2025;104(12):1741-1748. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1741-1748. EDN: luesxg
JATS XML









































