Перейти к:
Нейрофизиологические и иммунобиохимические изменения у лиц, работавших в контакте с ртутью, и не экспонированного в производственных условиях населения
https://doi.org/10.47470/0016-9900-2025-104-12-1749-1756
EDN: kkbauy
Аннотация
Введение. Объекты накопленного вреда, содержащие опасные загрязняющие вещества, являются потенциальными и реальными источниками негативного воздействия на окружающую среду, что способствует значительному ухудшению здоровья населения и сокращает качество и продолжительность жизни [1]. При деятельности промышленного объекта ООО «Усольехимпром» (Усольский район) было обнаружено, что у людей, живущих рядом с местами вторичного загрязнения, уровень ртути в организме был выше допустимых значений [5]. Только у 42,8% людей концентрация ртути была в пределах нормы [6]. Была изучена заболеваемость населения г. Усолье-Сибирское. По данным литературы, причинами повышенной заболеваемости были загрязнение окружающей среды и отдалённые последствия воздействия вредных производственных факторов [12‒14].
Цель исследования ‒ изучить нейрофизиологические и иммунобиохимические изменения у работавших на производстве при ингаляционной экспозиции ртутью и взрослого населения в зависимости от удалённости места проживания от очага загрязнения.
Материалы и методы. Группа 1 ‒ стажированные работники, контактировавшие с ртутью (средний возраст 49,2 ± 4,4 года); группа 2 – лица, подвергшиеся хронической ртутной интоксикации в отдалённом периоде (ХРИ, средний возраст 53,4 ± 4,3 года); группа 3 – лица, проживающие на расстоянии менее 3 км от промплощадки (средний возраст 47,4 ± 3,9 года), группа 4 – лица, проживающие на расстоянии 3‒5 км от промплощадки (средний возраст 48,1 ± 4 года). Обследуемым проводили электроэнцефалографию, электронейромиографию, определяли серотонин, дофамин, BDNF, концентрацию нейротропных антител к основному белку миелина (ОБМ), к вольтаж-зависимым кальциевым каналам и дофаминовым рецепторам.
Результаты. В группе 1 обнаружены умеренные изменения биоэлектрической активности мозга с высокой β1-активностью, дисфункцией срединных структур, очаговыми изменениями в лобно-височных отделах, в группе 2 – медленноволновая активность Δ-диапазона в лобных отделах, в группах 3 и 4 – изменения в меньшей степени выраженности. В группе 1 снижалась скорость проведения импульса по локтевому нерву в локтевом суставе, по большеберцовому нерву; в группах 2 и 3 наблюдали снижение по срединному и локтевому нервам соответственно; в группе 4 – возрастание проксимально-дистального коэффициента. В группе 1 снижался серотонин и BDNF, в группе 2 возрастали дофамин, антитела к вольтаж-зависимым кальциевым каналам, ОБМ, снижался BDNF; в группах 3 и 4 снижались дофамин, антитела к дофаминовым рецепторам и BDNF.
Ограничения исследования. Не установлена сопряжённость содержания нейромедиаторов и ЭЭГ и ЭНМГ.
Заключение. У лиц, не работавших с токсикантом, формировались умеренные общемозговые изменения головного мозга, полиритмичная полиморфная активность, высокий уровень медленноволновой активности, изменения правильного распределения основных ритмов, очаг патологической активности, дисфункция срединных структур. Регистрировались изменения сенсорных и моторных аксонов, дисбаланс в системе нейромедиаторов и синтезе антител.
Соблюдение этических стандартов. Заключение ЛЭК Федерального государственного бюджетного научного учреждения «Восточно-Сибирский институт медико-экологических исследований» № 1 от 21.02.2023 г. Все участники дали информированное добровольное письменное согласие на участие в исследовании.
Участие авторов:
Русанова Д.В. – концепция и дизайн исследования, сбор материала, обработка данных, статистический анализ, написание текста, структурирование статьи, редактирование;
Катаманова Е.В. – обработка данных, статистический анализ, написание текста;
Кудаева И.В. – концепция и дизайн исследования, сбор материала, обработка данных, написание текста;
Лахман О.Л. – концепция исследования, редактирование;
Протасова Е.Н. – сбор материала и обработка данных, статистическая обработка, написание текста;
Прохорова П.Г., Старкова А.С. – сбор материала.
Все соавторы – утверждение окончательного варианта статьи, ответственность за целостность всех частей статьи.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Финансирование. Финансирование осуществлялось в рамках выполнения Государственного задания по поисковым научным исследованиям. Исследование не имело спонсорской поддержки.
Поступила: 07.10.2025 / Поступила после доработки: 26.11.2025 / Принята к печати: 02.12.2025 / Опубликована: 15.01.2026
Ключевые слова
Для цитирования:
Русанова Д.В., Катаманова Е.В., Кудаева И.В., Лахман О.Л., Протасова Е.Н., Прохорова П.Г., Старкова А.С. Нейрофизиологические и иммунобиохимические изменения у лиц, работавших в контакте с ртутью, и не экспонированного в производственных условиях населения. Гигиена и санитария. 2025;104(12):1749-1756. https://doi.org/10.47470/0016-9900-2025-104-12-1749-1756. EDN: kkbauy
For citation:
Rusanova D.V., Katamanova Е.V., Kudaeva I.V., Lakhman O.L., Protasova Е.N., Prokhorova P.G., Starkova A.S. Neurophysiological and immunobiochemical changes in workers exposed to mercury and the general population. Hygiene and Sanitation. 2025;104(12):1749-1756. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1749-1756. EDN: kkbauy
Введение
Известно, что объекты накопленного вреда, содержащие опасные загрязняющие вещества, являются источниками негативного воздействия на окружающую среду, которое обусловливает значительное ухудшение здоровья людей, сокращает продолжительность жизни [1]. Яркий пример – промышленное загрязнение предприятием ООО «Усольехимпром» площади в 600 га территории, на которой захоронено более 10 000 т токсических отходов, одним из которых является металлическая ртуть, представляющая наибольшую опасность. Ртуть, активно применяемая в промышленности, – глобальный загрязнитель с нейротоксичными свойствами [2–4]. Было установлено, что в результате деятельности промышленного объекта ООО «Усольехимпром» (Усольский район) у людей, живущих рядом с местами вторичного загрязнения, содержание ртути в организме было выше допустимых значений [5], и только у 42,8% концентрация ртути не превышала нормальных значений [6].
Сотрудники ФГБНУ «Восточно-Сибирский институт медико-экологических исследований» установили, что воздействие ртути обусловливало негативные последствия для здоровья: психопатологические проявления и неврологическую симптоматику, в том числе энцефалопатии и невропатии, выраженный психоорганический синдром [7–9]. У лиц, подвергшихся воздействию ртути, наблюдались изменения в концентрации норадреналина, отмечалось повышение уровня дофамина, серотонина и гистамина [10, 11].
Диагностика нарушений здоровья, возникающих при производственном воздействии химических веществ, у жителей городов, на территории которых расположены предприятия химической промышленности, – одна из актуальных задач профилактической медицины. Авторы провели исследование заболеваемости населения г. Усолье-Сибирское. По данным литературы, причинами её повышения были загрязнение окружающей среды и отдалённые последствия воздействия вредных производственных факторов [12–14]. Однако если у работников химического предприятия, контактировавших с парами металлической ртути, считается доказанной корреляция патологических изменений ЦНС и периферических нервов и контакта с токсикантом, то у населения, проживающего в зоне, загрязнённой тяжёлыми металлами, такая взаимосвязь не выявлена.
Цель исследования – изучить нейрофизиологические и иммунобиохимические изменения при ингаляционной экспозиции ртутью работавших на производстве и взрослого населения в зависимости от удалённости места проживания от очага ртутного загрязнения.
Материалы и методы
Обследованы лица мужского пола: группа 1 – стажированные работники химического производства, подвергавшиеся воздействию металлической ртути (n = 47, средний возраст 49,2 ± 4,4 года, стаж 18,1 ± 5,6 года); группа 2 – пациенты в отдалённом периоде хронической ртутной интоксикации (ХРИ) (n = 51, средний возраст 53,4 ± 4,3 года, стаж 15,7 ± 2,7 года). В период наблюдения средние концентрации ртути достигали в рабочей зоне 0,046 мг/м³, максимальные значения – до 0,05 мг/м³, что выше ПДК в 2–5 раз. В цехе ртутного электролиза, где работали обследованные, с 1987 по 1992 г. концентрации ртути превышали ПДК в 8–20 раз и составляли 0,08–0,2 мг/м³ [5].
На следующем этапе обследовали взрослое население г. Усолье-Сибирское. Критерии включения – постоянное проживание с подветренной стороны от промплощадки ООО «Усольехимпром» на экспонированной ртутью территории. Критерии исключения: работа в цехе ртутного электролиза и предприятий, где ртуть является элементом технологического процесса; контакт с ртутью в результате бытового загрязнения, аварийных ситуаций; наличие на момент обследования острых инфекционных болезней, обострение хронических болезней. Все обследованные – лица мужского пола. По удалённости места жительства от промплощадки были сформированы две группы: I зона – группа 3 (средний возраст 47,4 ± 3,9 года); II зона – группа 4 (средний возраст 48,1 ± 4 года). В I зоне (менее 3 км от промплощадки) проживали 40 ± 9,1% обследованных, во II зоне (3–5 км) – 60 ± 7,9% обследованных. Результаты сопоставляли с группой сравнения (n = 36, мужчины, не имевшие контакта с токсическими веществами, средний возраст 51,6 ± 6,8 года).
Наряду с высоким содержанием ртути до 2006 г. было выявлено снижение уровня ингаляционной нагрузки в 2007–2023 гг. по сравнению с уровнями до 2000 г.: в группе 1 – в 12,6 раза; в группе 2 – в 10,2 раза. Такая динамика обусловлена меньшим загрязнением воздушной среды промплощадки после прекращения использования ртути в технологическом процессе [15].
Электроэнцефалографию (ЭЭГ) выполняли с использованием многофункционального комплекса «Нейрон-Спектр-5». Анализ ЭЭГ включал изучение основных нормальных и патологических ритмов. При описании каждого ритма указывались: частота, характерная для определённого состояния и области мозга; индекс и представленность ритма; особенности изменений ритма во времени при изменении функциональной активности мозга; наличие эпилептиформной активности [16]. Стимуляционная электронейромиография (ЭНМГ) была выполнена с помощью электронейромиографа «Нейро-ЭМГ-Микро» («Нейрософт», Иваново). Исследование заключалось в анализе состояния сенсорных и моторных волокон срединного и локтевого нервов. Процедура включала стандартное размещение поверхностных пластинчатых электродов для регистрации. Оценку функциональности сенсорных аксонов проводили по антидромной методике тестирования. Для количественного определения уровней серотонина, дофамина и мозгового нейротрофического фактора использовали метод твердофазного конкурентного иммуноферментного анализа на микропланшетах с применением соответствующих тест-наборов производства Cloud-Clone Corp.: 5-Hydroxytryptophan (5-HTP), Dopamine (DA), Brain Derived Neurotrophic Factor (BDNF) соответственно. В сыворотке крови также анализировали концентрацию нейротропных аутоантител (АТ) класса G методом твердофазного иммуноферментного анализа и с помощью оригинальной идиотип-антиидиотипической тест-системы «ЭЛИ-Н-Тест» (Россия). Для определения уровня АТ иммуноферментным методом использовали автоматический анализатор Gemini (Stratec Biomedical, Германия).
Все процедуры выполнены в соответствии с этическими стандартами. Каждый участник получал информацию о целях, методах и потенциальных рисках, дал согласие на участие в исследовании. Согласие было одобрено Комитетом по биомедицинской этике ФГБНУ ВСИМЭИ (заключение ЛЭК № 1 от 21.02.2023 г.). Таким образом, права и благополучие участников были защищены, здоровью не был причинён вред.
Результаты
При исследовании ЭЭГ у всех пациентов обнаружены изменения: дезорганизация активности ЭЭГ и появление медленных волн. Наиболее значительные отклонения от нормы установлены в группе 2: диффузная асинхронная активность в диапазонах медленных Θ- и Δ-волн, указывающая на структурные изменения, особенно в подкорковых областях. Выраженные отклонения наблюдались у 47,3% участников, умеренные ‒ у 50%. Вышеописанный паттерн отклонений выявлялся у 25%, умеренные нарушения ‒ у 72,5%. В группе 1 изменения были менее выражены. Результаты существенно отличались от полученных в группах 3 и 4 и в группе сравнения. Анализ показателей в группах 3 и 4 значимых различий не выявил, но были зафиксированы умеренные общемозговые изменения. Патологическое воздействие соединений ртути на срединные отделы мозга выявлено у всех участников исследования. Активность верхнестволовых структур подтверждалась наличием вспышек Θ- и Δ-волн, а нижнестволовых ‒ пароксизмами высокоамплитудных (свыше 120 мкВ) гиперсинхронных α-волн. Наиболее выраженные нарушения в области срединных отделов наблюдались в группах 1 и 2, а в группах 3 и 4 такие отклонения встречались значительно реже (табл. 1).

У обследованных выявлены очаговые изменения в височных, лобных, затылочно-теменных отделах. Изменения регистрировались в виде медленноволновой активности в форме пароксизмов в Θ-диапазоне. Чаще патологические нарушения в виде отдельных очагов наблюдались в группах 1 и 2 при ХРИ в лобных отведениях (табл. 2).

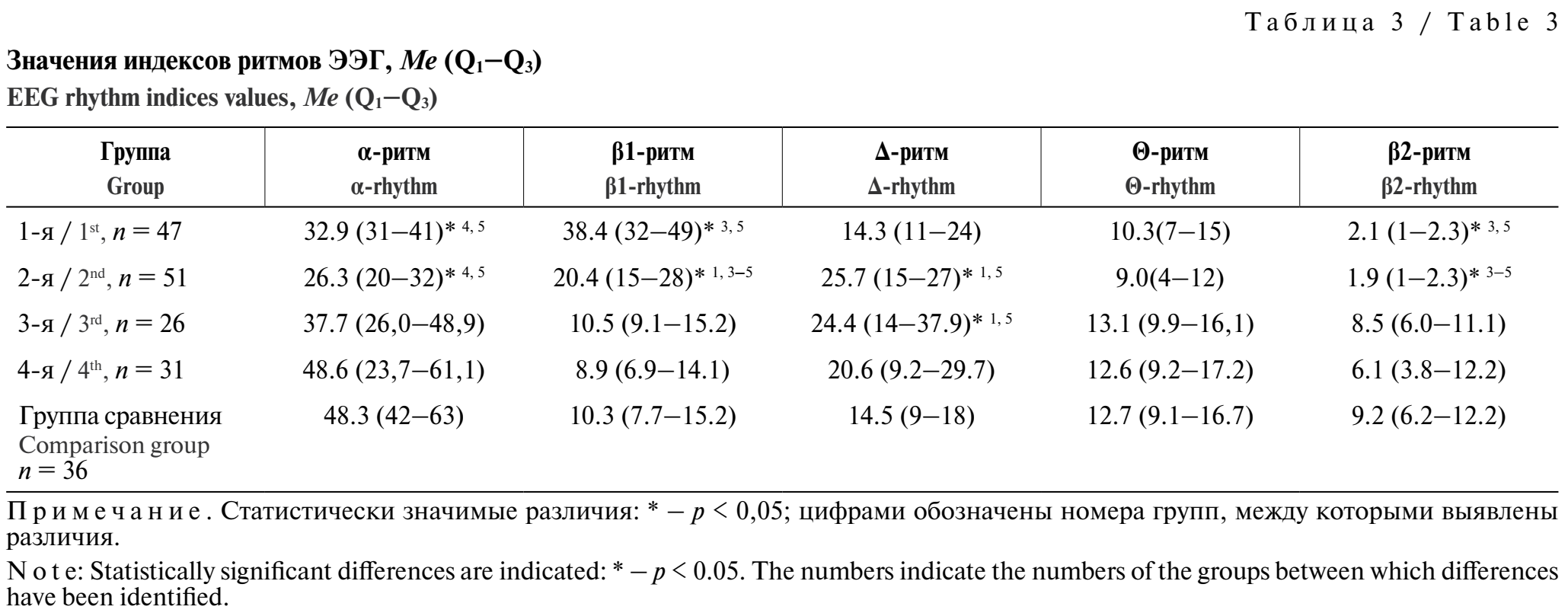
Сравнение индексов активности волн показало различия между группами 1 и 2 по Δ-индексу и β1-индексу. Во второй группе наблюдалась более высокая Δ-активность, в первой группе преобладала β1-активность. Во второй группе α-ритм встречался реже, а β-ритм и активность Δ-диапазона были более выражены. Между группами 3 и 4 значимых различий в распределении ритмов не обнаружено, однако активность Δ-диапазона в этих группах была выше по сравнению с группой сравнения (табл. 3).
Состояние периферических нервов в группе 1 при сопоставлении результатов с группой сравнения характеризовалось снижением скорости распространения возбуждения импульса (СПИ) в ногах, возрастанием резидуальной латентности срединного нерва, поражением локтевого нерва в области локтя. При ХРИ снижалась СПИ по моторным аксонам в руках и в области локтевого сустава локтевого нерва (табл. 4).
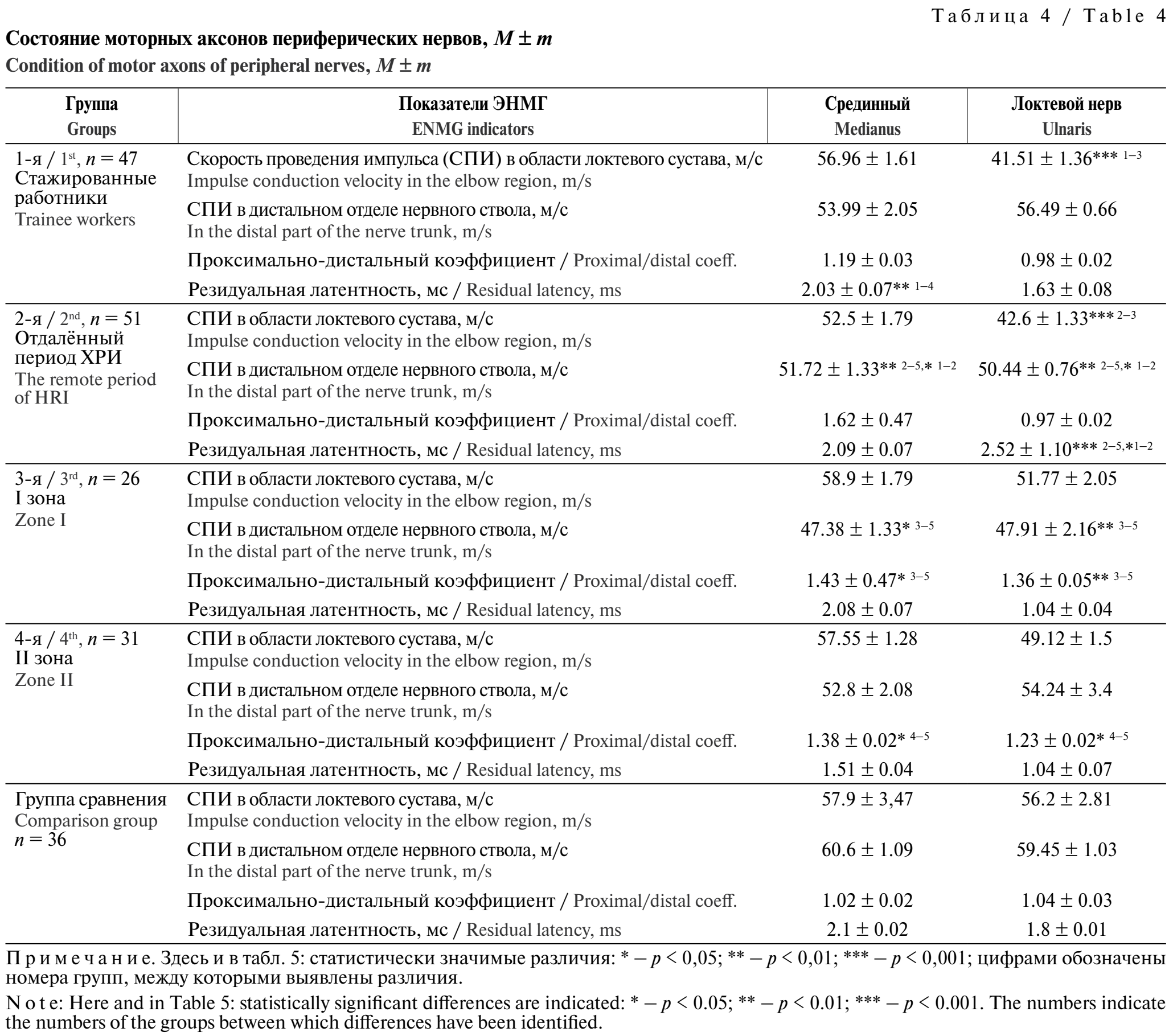
У пациентов группы 3 было обнаружено снижение СПИ в дистальном отделе срединного и локтевого нерва. В группах 3 и 4 увеличивался проксимально-дистальный коэффициент. При исследовании сенсорных аксонов периферических нервов в группе 1 было выявлено снижение амплитуды потенциалов действия (ПД) срединного и локтевого нервов, фиксировалось снижение СПИ по локтевому нерву (табл. 5). В группе 2 наблюдалось снижение амплитуды ПД и СПИ по нервам на руках.

В группах 3 и 4 уровень дофамина, АТ к дофаминовым рецепторам и BDNF был статистически значимо ниже, чем в группе сравнения (табл. 6). Установлена кратность межгрупповых различий по дофамину и BDNF – в 3 и 5 раз соответственно.

Обсуждение
В группах обследованных выявлены сходные изменения на ЭЭГ, которые указывали на умеренные диффузные нарушения: наличие полиритмичной полиморфной активности с увеличенной долей медленных волн; неравномерное распределение ключевых ритмов по разным областям мозга; нарушение правильного топического распределения основных ритмов ЭЭГ; наличие очага патологической активности различной локализации; дисфункцию срединных структур; изменение интегральных характеристик ЭЭГ. Общность этих признаков подтверждает токсическое воздействие ртути на структуры головного мозга, особенно на подкорковые зоны.
Изменения в сенсорных и моторных аксонах верхних конечностей у обследованных группы 1 заключались в снижении СПИ в области локтя по локтевому нерву и возрастание РЛ срединного и локтевого нервов. В отдалённом периоде ХРИ снижалась СПИ в дистальном отделе моторного компонента и возрастала РЛ на руках. По сенсорному компоненту снижалась амплитуда ПД нервного ствола и СПИ не только в группе 1, но и в группе 2, когда контакта с токсикантом не было на протяжении длительного времени.
У лиц, проживающих в загрязнённой ртутью зоне, изменения в периферических аксонах характеризовались снижением СПИ по моторному компоненту в дистальном отделе локтевого нерва (группа 3); возрастанием проксимально-дистального коэффициента на верхних конечностях, что говорит об относительном снижении СПИ в дистальном отделе аксонов. Снижение СПИ в дистальном отделе срединного нерва установлено у 60% лиц группы 3 и у 45% лиц группы 4; по локтевому нерву снижение выявлено у 55% обследованных группы 3 и у 48% обследованных группы 4. По сенсорному компоненту установлено снижение СПИ по локтевому нерву в группах обследованных 3 и 4.
В работах сотрудников ФГБНУ ВСИМЭИ показано, что патология центральных и периферических проводящих путей, возникшая вследствие воздействия ртути, индуцируется антигенными структурами [17, 18]. Возрастание количества иммунных клеток сопряжено с демиелинизацией аксонов, гибелью олигодендроцитов в ЦНС. Установленное увеличение времени прохождения импульса по проводящим структурам нервной системы, возможно, подтверждает вклад перечисленных процессов в блокирование ремиелинизации. Вероятно, выявленные нами изменения относятся к универсальной форме реакции нервной системы на патологическое воздействие – нарушении миелиновой оболочки.
У лиц, проживающих в непосредственной близости от промплощадки (группы 3 и 4), обнаруженные АТ являются, вероятно, предвестниками развития неврологических нарушений. Одно из объяснений низких уровней аутоантител может быть связано с повышенными уровнями антигенсвязанных АТ и образованием иммунных комплексов, что подтверждалось результатами исследования Maftei M. и соавт. [19]. Изменение титра АТ к дофаминергическим рецепторам свидетельствует о нарушениях в работе соответствующих нейронных систем [20]. Если уровень АТ, направленных против данных рецепторов, повышается, это может мешать их взаимодействию с нейромедиатором или влиять на проводимость по сигнальным путям, что способствует развитию патологий ЦНС [21]. Поэтому контроль уровня АТ у лиц, подвергавшихся воздействию паров ртути, прогностически значим и указывает на необходимость тщательного и регулярного мониторинга состояния ЦНС.
Также для обследованных, проживающих в непосредственной близости от промплощадки (группы 3 и 4), установлено снижение содержания дофамина и BDNF. Ранее было показано, что у стажированных работников, контактировавших с ртутью, отмечалось снижение содержания серотонина, а у пациентов в отдалённом периоде ХРИ возрастала концентрация дофамина и снижался уровень BDNF [11]. Низкие значения BDNF, выявленные у этих пациентов, сопоставимы с патологическими изменениями в структурах головного мозга, установленными с помощью ЭЭГ [22, 23]. Известно, что BDNF участвует в регуляции дифференцировки нейрональных клеток, процессах ветвления дендритов и формирования новых синапсов [24]. Снижение уровня BDNF может свидетельствовать о нарушениях восстановления нервной ткани. Сбалансированное взаимодействие иммунобиохимических компонентов обеспечивает нормальное функционирование нервной системы [25]. У людей, проживающих вблизи промышленной зоны, выявлены нейрофизиологические и иммунобиохимические нарушения, что свидетельствует о сложных патологических изменениях при воздействии металлической ртути [26, 27].
Заключение
Таким образом, установлено, что у лиц, проживающих в непосредственной близости от промплощадки химического комбината, но не подвергавшихся воздействию металлической ртути на производстве, формируются однонаправленные, но менее выраженные изменения по сравнению с теми, что были выявлены у работников, подвергавшихся воздействию токсиканта на производстве. У обследованных жителей определяются патологические изменения в ЦНС при тестировании сенсорных и моторных аксонов периферических нервов. Установлен дисбаланс нейромедиаторов, что может являться одним из факторов, лежащих в основе развития установленных нами нарушений по ЭЭГ и в периферических нервах. Полученные результаты подтверждают важность дальнейших комплексных исследований здоровья населения, проживающего в зонах выбросов ртутных производств, что неоднократно обосновывалось литературными данными [28]. Экологический ущерб, нанесённый деятельностью вредного химического производства, следует оценивать как значительный.
Список литературы
1. Пичугин Е.А., Шенфельд Б.Е. Здоровье граждан и продолжительность их жизни как критерий при оценке негативного воздействия объектов накопленного вреда на состояние окружающей среды и человека. Экология урбанизированных территорий. 2021; (3): 62–70. https://elibrary.ru/mdybdh
2. Cabascango V.E.Q., Bazhin V.Y., Martynov S.A. Automatic control system for thermal state of reverberatory furnaces in production of nickel alloys. Metallurgist. 2022; 66(12): 104–16. https://doi.org/10.1007/s11015-022-01304-3 https://elibrary.ru/eiptxm
3. Steckling N. Global burden of disease of mercury. Ann. Glob. Health. 2017; 83(2): 234–43.
4. Сазонов Г.В., Бузикова О.М. Ртутная промышленность, производство и добыча ртути. Вестник науки. 2023; 1(6): 1041–5. https://elibrary.ru/ineoja
5. Ефимова Н.В., Лисецкая Л.Г. Содержание ртути в биосубстратах населения Иркутской области. Токсикологический вестник. 2007; (3): 11–5. https://elibrary.ru/iavtht
6. Савченков М.Ф., Рукавишников В.С., Ефимова Н.В. Ртуть в окружающей среде и ее влияние на здоровье населения (на примере Байкальского региона). Сибирский медицинский журнал (Иркутск). 2010; 99(8): 9–11. https://elibrary.ru/nhoebf
7. Катаманова Е.В., Шевченко О.И., Лахман О.Л. Зависимость состояния нейромедиаторного обмена и изменений в психической сфере при профессиональном контакте с нейротоксикантами. В кн.: Общие закономерности формирования профессиональных и экологически обусловленных заболеваний: патогенез, диагностика, профилактика. Сборник материалов Всероссийской конференции. Ангарск; 2014: 50–5. https://elibrary.ru/swwdqn
8. Лахман О.Л., Рукавишников В.С., Шаяхметов С.Ф., Соседова Л.М., Катаманова Е.В., Бодиенкова Г.М. и др. Профессиональные нейроинтоксикации: клинико-экспериментальные исследования. Медицина труда и промышленная экология. 2015; 55(9): 82–3. https://elibrary.ru/umgqnh
9. Шевченко О.И., Катаманова Е.В., Лахман О.Л. Особенности психопатологических изменений у больных с хронической ртутной интоксикацией. Доктор.Ру. 2015; (8–9): 59–64. https://elibrary.ru/vecacp
10. Кудаева И.В., Маснавиева Л.Б., Попкова О.В., Дьякович О.А. Изменение нейрохимических показателей у лиц, экспонированных парами ртути. Медицина труда и промышленная экология. 2015; 55(4): 11–5. https://elibrary.ru/trllpl
11. Кудаева И.В., Рукавишников В.С., Лахман О.Л. Особенности и закономерности изменений нейрохимических показателей на разных этапах хронической интоксикации ртутью. Гигиена и санитария. 2021; 100(12): 1462–66. https://doi.org/10.47470/0016-9900-2021-100-12-1462-1466 https://elibrary.ru/khayux
12. Ведышева Т.В. К вопросу о факторах формирования здоровья населения Иркутской области. Сибирский медицинский журнал. 2008; 80(5): 75–7. https://elibrary.ru/jvrumz
13. Голиков Р.А., Суржиков Д.В., Кислицына В.В. Влияние загрязнения окружающей среды на здоровье населения. Научное обозрение. Медицинские науки. 2017; (5): 20–31. https://elibrary.ru/zcrukz
14. Урожаева Т.П. Экологические и медико-демографические проблемы городов Иркутской области в 1990-е гг. Ученые записки Орловского государственного университета. Серия: Гуманитарные и социальные науки. 2015; (6): 366–70. https://elibrary.ru/yidfsl
15. Дьякович М.П., Мещакова Н.М., Казакова П.В., Соловьева И.Ю. Влияние стажевой ртутной нагрузки на динамику хронической ртутной интоксикации профессионального генеза. Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2010; (1): 36–9. https://elibrary.ru/oopwvn
16. Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике. М.: МЕДпресс-ин; 2003.
17. Бодиенкова Г.М., Рукавишников В.С., Боклаженко Е.В. Оценка иммунорегуляторных маркеров в течение интоксикации ртутью в постконтактном периоде. Гигиена и санитария. 2016; 95(12): 1138–41. https://elibrary.ru/xqrzot
18. Бодиенкова Г.М., Боклаженко Е.В. Иммунологические критерии диагностики нейроинтоксикации парами металлической ртути. Техносферная безопасность. 2016; 1(4): 23–9. https://elibrary.ru/xdblix
19. Maftei M., Thurm F., Schnack C., Tumani H., Otto M., Elbert T., et al. Increased levels of antigen-bound β-amyloid autoantibodies in serum and cerebrospinal fluid of Alzheimer’s disease patients. PLoS One. 2013; 8(7): e68996. https://doi.org/10.1371/journal.pone.0068996
20. Расулова Х.А., Азизова Р.Б. Естественные нейротропные аутоантитела в сыворотке крови больных, страдающих эпилепсией. Вестник Российской академии медицинских наук. 2014; 69(5–6): 111–16. https://doi.org/10.15690/vramn.v69i5-6.1054 https://elibrary.ru/shnuyh
21. Lavi Y., Vojdani A., Halpert G., Sharif K., Ostrinski Y., Zyskind I., et al. Dysregulated levels of circulating autoantibodies against neuronal and nervous system autoantigens in COVID-19 patients. Diagnostics (Basel). 2023; 13(4): 687. https://doi.org/10.3390/diagnostics13040687
22. Ron D., Berger A. Targeting the intracellular signaling “STOP” and “GO” pathways for the treatment of alcohol use disorders. Psychopharmacology (Berl.). 2018; 235(6): 1727–43. https://doi.org/10.1007/s00213-018-4882-z
23. Wang C.S., Kavalali E.T., Monteggia L.M. BDNF signaling in context: From synaptic regulation to psychiatric disorders. Cell. 2022; 185(1): 620–76. https://doi.org/10.1016/j.cell.2021.12.003
24. Русанова Д.В., Лахман О.Л., Кудаева И.В., Купцова Н.Г. Роль нейромедиаторов и показателей оксидативного стресса в формировании нарушений центральных проводящих структур у пациентов, контактировавших с металлической ртутью. Медицина труда и промышленная экология. 2022; 62(12): 802–8. https://doi.org/10.31089/1026-9428-2022-62-12-802-808 https://elibrary.ru/zxxwih
25. Slifstein M., Kegeles L.S., Xu X., Thompson J.L., Urban N., Castrillon J., et al. Striatal and extrastriatal dopamine release measured with PET and [(18)F] fallypride. Synapse. 2010; 64(5): 350–62. https://doi.org/10.1002/syn.20734
26. Кудаева И.В., Наумова О.В., Дьякович О.А., Маснавиева Л.Б. Вопросы патогенетических взаимоотношений нейрохимических показателей при хроническом воздействии ртути. Гигиена и санитария. 2020; 99(10): 1127–31. https://doi.org/10.47470/0016-9900-2020-99-10-1127-1131 https://elibrary.ru/ylhaot
27. Ракитский В.Н., Синицкая Т.А., Скупневский С.В. Современные проблемы загрязнения ртутью окружающей среды. Гигиена и санитария. 2020; 99(5): 460–7. https://doi.org/10.47470/0016-9900-2020-99-5-460-467 https://elibrary.ru/cxkmri
28. Рапута В.Ф., Юсупов Д.В., Ярославцева Т.В., Ляпина Е.Е., Турсуналиева Е.М. Экспериментальное исследование и численный анализ распространения ртути в окрестностях Новосибирского завода химконцентратов. Интерэкспо Гео-Сибирь. 2018; 2(4): 48-58.
Об авторах
Дина Владимировна РусановаРоссия
Доктор биол. наук, ст. науч. сотр. лаб. профессиональной и экологически обусловленной патологии ФГБНУ ВСИМЭИ, 665827, Ангарск, Россия
e-mail: dina.rusanova@yandex.ru
Елена Владимировна Катаманова
Россия
Доктор мед. наук, профессор, главный врач клиники ФГБНУ «Восточно-Сибирский институт медико-экологических исследований», 665827, Ангарск, Россия
e-mail: aniimt_clinic@mail.ru
Ирина Валерьевна Кудаева
Россия
Доктор мед. наук, доцент, зам. директора по научной работе, зав. клинико-диагностической лаб. ФГБНУ ВСИМЭИ, 665827, Ангарск, Россия
e-mail: kudaeva_irina@mail.ru
Олег Леонидович Лахман
Россия
Доктор мед. наук, профессор, профессор РАН, директор ФГБНУ ВСИМЭИ, 665827, Ангарск, Россия
e-mail: lakhman_o_l@mail.ru
Елена Николаевна Протасова
Россия
Зав. лаб. функциональной диагностики ФГБНУ ВСИМЭИ, 665827, Ангарск, Россия
e-mail: kor.052@mail.ru
Полина Германовна Прохорова
Россия
Врач клинической лабораторной диагностики ФГБНУ ВСИМЭИ, 665827, Ангарск, Россия
e-mail: hurwol@yandex.ru
Алла Сергеевна Старкова
Россия
Врач клинической лабораторной диагностики, ФГБНУ ВСИМЭИ, 665827, Ангарск, Россия
e-mail: karpova.alana123@yandex.ru
Рецензия
Для цитирования:
Русанова Д.В., Катаманова Е.В., Кудаева И.В., Лахман О.Л., Протасова Е.Н., Прохорова П.Г., Старкова А.С. Нейрофизиологические и иммунобиохимические изменения у лиц, работавших в контакте с ртутью, и не экспонированного в производственных условиях населения. Гигиена и санитария. 2025;104(12):1749-1756. https://doi.org/10.47470/0016-9900-2025-104-12-1749-1756. EDN: kkbauy
For citation:
Rusanova D.V., Katamanova Е.V., Kudaeva I.V., Lakhman O.L., Protasova Е.N., Prokhorova P.G., Starkova A.S. Neurophysiological and immunobiochemical changes in workers exposed to mercury and the general population. Hygiene and Sanitation. 2025;104(12):1749-1756. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1749-1756. EDN: kkbauy
JATS XML









































