Перейти к:
Научно-практическое значение расширенного микробиологического анализа плавающих взвесей (биоплёнок) в упакованной минеральной природной столовой питьевой воде
https://doi.org/10.47470/0016-9900-2025-104-12-1582-1588
EDN: jqrjsc
Аннотация
Введение. Проблема биоплёнок в системах питьевого водоснабжения хорошо изучена, однако их наличие в бутилированной воде требует дополнительного внимания.
Цель исследования – оценка микробиологического состава и потенциального риска прозрачных взвесей (осадка), обнаруженных в бутилированной минеральной природной столовой негазированной питьевой воде.
Материалы и методы. Проведено комплексное санитарно-микробиологическое исследование воды. Стандартный анализ на соответствие требованиям ТР ЕАЭС 044/2017* включал определение нормируемых показателей (ОМЧ, БГКП, E. coli, P. aeruginosa, энтерококки) по ГОСТ 34786–2021. Для анализа взвесей использованы методы концентрирования больших объёмов воды (1 и 3 дм³) путём центрифугирования и мембранной фильтрации с последующим посевом на питательные среды (МПА, среда Эндо, Сабуро, Br, MRS) прямым методом и через тиогликолевую среду накопления. Видовая идентификация всех выросших колоний выполнена методом времяпролётной масс-спектрометрии (MALDI-TOF MS). Дополнительно проводили исследования на колифаги и паразитологические объекты.
Результаты. Стандартный анализ 250 см³ воды не выявил E. coli, БГКП и других нормируемых патогенов. Зафиксировано превышение норматива по ОМЧ при температуре плюс 22 °C в два раза (289 КОЕ/см³), однако в данном случае это исследование в соответствии с ТР ЕАЭС 044/2017 не требовалось проводить. После концентрирования 1 и 3 дм³ воды в составе взвесей идентифицированы разнообразные микроорганизмы, в том числе Escherichia coli, Kocuria rhizophila, Micrococcus luteus, Aquabacterium parvum, Microbacterium testaceum, а также грибы Aspergillus fumigatus и Syncephalastrum racemosum. Колифаги и паразитарные объекты не обнаружены.
Ограничения исследования. Исследование проведено однократно на одной партии бутилированной минеральной природной питьевой воды. Необходимо выполнить аналогичные исследования биоплёнок другого состава для подтверждения правильности выработанной тактики.
Заключение. Результаты демонстрируют, что стандартных методов контроля, основанных на анализе малых объёмов (до 250 см³), может быть недостаточно для выявления микробиологической контаминации, присутствующей в виде локальных скоплений (взвесей или биоплёнок) в бутилированной воде. Обнаружение E. coli после концентрирования указывает на фекальное загрязнение и потенциальный эпидемиологический риск. Полученные данные обосновывают необходимость разработки и внедрения расширенных протоколов контроля с концентрированием репрезентативных объёмов воды и использованием сред накопления для обеспечения безопасности упакованной питьевой воды.
Соблюдение этических стандартов. Исследование не требует заключения комитета по биомедицинской этике.
Участие авторов:
Алексеева А.В. – концепция и дизайн исследования, сбор материала и обработка данных, написание текста, редактирование, утверждение окончательного варианта статьи и ответственность за целостность всех её частей;
Загайнова А.В. – концепция и дизайн исследования, редактирование;
Рахманин Ю.А., Русаков Н.В. – редактирование, утверждение окончательного варианта статьи;
Курбатова И.В., Кравченко К.С. – сбор материала и обработка данных.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Финансирование. Исследование осуществлено в рамках государственного задания.
Поступила: 11.06.2025 / Поступила после доработки: 27.11.2025 / Принята к печати: 02.12.2025 / Опубликована: 15.01.2026
* ТР ЕАЭС 044/2017 Технический регламент Евразийского экономического союза «О безопасности упакованной питьевой воды, включая природную минеральную воду», принят решением Совета Евразийской экономической комиссии от 23 июня 2017 года № 45.
Ключевые слова
Для цитирования:
Алексеева А.В., Загайнова А.В., Рахманин Ю.А., Курбатова И.В., Кравченко Е.С., Русаков Н.В. Научно-практическое значение расширенного микробиологического анализа плавающих взвесей (биоплёнок) в упакованной минеральной природной столовой питьевой воде. Гигиена и санитария. 2025;104(12):1582-1588. https://doi.org/10.47470/0016-9900-2025-104-12-1582-1588. EDN: jqrjsc
For citation:
Alekseeva A.V., Zagainova A.V., Rakhmanin Yu.A., Kurbatova I.V., Kravchenko E.S., Rusakov N.V. Scientific and practical significance of extended microbiological analysis of floating suspensions (biofilms) in packaged natural mineral table drinking water. Hygiene and Sanitation. 2025;104(12):1582-1588. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1582-1588. EDN: jqrjsc
Введение
Современная микробиология рассматривает биоплёнки как преобладающую форму существования микроорганизмов в окружающей среде [1, 2]. Эти структурированные сообщества, заключённые в вырабатываемый ими внеклеточный полимерный матрикс (ВПМ), демонстрируют не только высокую степень организации, но и исключительную устойчивость к неблагоприятным факторам, в том числе дезинфектантам и антибиотикам [3, 4]. ВПМ выполняет роль защитного барьера, обеспечивает механическую стабильность и выступает в качестве накопителя питательных веществ, делая биоплёнки доминирующей стратегией выживания микроорганизмов [5].
В контексте безопасности питьевой воды проблема биоплёнок долгое время ассоциировалась с системами централизованного водоснабжения, однако накопленные научные данные свидетельствуют о том, что бутилированная питьевая вода не является стерильной средой и также подвержена биологическому обрастанию [6]. Существуют потенциальные микробиологические риски, связанные с формированием аутохтонных микробных сообществ, как в толще воды (планктонные биоплёнки, взвеси), так и на всех этапах производственно-логистической цепи: от исходной воды и технологического оборудования до внутренних поверхностей упаковки (пристенные биоплёнки) [6, 7].
Источники контаминации имеют множественный характер. Во-первых, это исходная вода, которая даже после многоступенчатой очистки может содержать низкие концентрации олиготрофных (способных выживать в условиях низкого содержания питательных веществ) микроорганизмов [8, 9]. Во-вторых, это технологическое оборудование: линии розлива, ёмкости для хранения, форсунки и клапаны, где могут формироваться стабильные пристенные биоплёнки, служащие постоянным источником контаминации продукта. В-третьих, и это особенно важно, – сама упаковка. Внутренняя поверхность бутылей из полиэтилентерефталата (ПЭТ) или других полимеров является идеальным субстратом для первичной адгезии микроорганизмов. Микроскопические царапины, шероховатости, а также миграция низкомолекулярных органических соединений (пластификаторов, остатков мономеров) из материала упаковки в воду создают благоприятные условия для закрепления пионерных бактерий и начала процесса биообрастания [10, 11].
Процесс формирования биоплёнки в бутилированной воде является каскадным и начинается с адгезии микроорганизмов на поверхности. Исследования подтверждают, что в бутилированной воде могут формироваться сложные многовидовые консорциумы. В частности, установлено присутствие биоплёнкообразующих и мультирезистентных штаммов Escherichia coli и других условно патогенных бактерий, что превращает упаковку в потенциальный экологический резервуар микроорганизмов, имеющих гигиеническое значение [12]. Другое исследование выявило, что биоплёнки в бутилированной воде могут быть представлены сообществами хемогетеротрофных актинобактерий, чьё развитие гипотетически связано с адсорбционными свойствами используемого на этапе водоподготовки активированного угля, который аккумулирует органику и становится платформой для адгезии и роста микроорганизмов [13].
Ограничивающим фактором для роста биоплёнки обычно является доступность питательных веществ, в основном предоставляемых биоразлагаемыми компонентами, которые выщелачиваются из используемых материалов и из самой водной среды. Интенсивность разрастания биоплёнки, условия и степень накопления в ней патогенных микроорганизмов требуют дальнейшего изучения [14–17].
Первыми на поверхности всегда поселяются бактерии, среди которых преобладают формы с мощной слизистой капсулой, скрепляющей клетки друг с другом. Роды, обнаруженные в биоплёнках, включают Enterococcus, Staphylococcus, Pseudomonas, Ralstonia, Mycobacteria, а также семейство Enterobacteriaceae и другие грамотрицательные бактерии [18–20]. Как бактерии, так и грибы способны образовывать биоплёнки. Нитчатые грибы и бактерии могут сосуществовать внутри этих систем, образуя межцарственные биоплёнки. При этом необходимо отметить, что устойчивость биоплёнки напрямую зависит от её видового разнообразия, и смешанные популяции обладают более высокой устойчивостью к антибиотикам и дезинфицирующим агентам [21–26].
В исследовании [21] показано, что присутствие Penicillium brevicompactum или Penicillium expansum в биоплёнках значительно снижало возможность инактивации и восприимчивость бактерий к дезинфекции, особенно к высоким концентрациям гипохлорита натрия, по сравнению с обеззараживанием воды в системах питьевого водоснабжения с бактериальными биоплёнками.
Требования к качеству воды, пригодной для питьевых целей, постоянно растут, поскольку расширяется сфера знаний о критериях её безопасности [27–29]. Для оценки упакованной питьевой воды (ТР ЕАЭС 044/2017) микробиологическую безопасность определяют по основным показателям бактериальной обсеменённости, таким как общее микробное число (ОМЧ) (ОМЧ при температуре плюс 22 °C, ОМЧ при температуре плюс 37 °C), Escherichia coli (E. coli), P. aeruginosa, бактерии группы кишечных палочек (БГКП) и энтерококки, в относительно небольших регламентированных объёмах. Однако данный подход может оказаться недостаточно чувствительным для выявления микробной контаминации, присутствующей в виде локальных скоплений или взвесей.
В ходе настоящего исследования в бутилированной минеральной воде были визуально обнаружены прозрачные взвеси (осадок) неизвестного происхождения.
Цель исследования – изучение состава данных взвесей с применением методов концентрирования и современной видовой идентификации для оценки их микробиологической природы и потенциального риска.
Материалы и методы
Объектом исследования была бутилированная минеральная природная столовая негазированная питьевая вода с общей минерализацией до 1 г/дм³, разлитая в стеклянную тару. Исследованию подвергли партию с датой изготовления 07.2024, представленную в 90 стеклянных бутылках объёмом 1 л каждая с ненарушенной упаковкой. Визуальный осмотр выявил наличие прозрачных взвесей (осадка) неизвестного происхождения в содержимом бутылок.
Исследования проводили в соответствии с ГОСТ 34786–2021¹. Определяли ОМЧ при температуре плюс 22 и плюс 37 °C, БГКП, E. coli, энтерококки и P. aeruginosa в объёмах, предусмотренных стандартом. Параллельно проводили санитарно-паразитологические исследования концентрированных объёмов воды (10 и 50 дм³) методом световой микроскопии в соответствии с МУК 4.2.2314–08², а также анализ на наличие колифагов в объёме 100 см³ как косвенного показателя вирусного загрязнения по МУК 4.2.3963–23³.
Для анализа взвесей использовали методы концентрирования больших объёмов воды. Центрифугирование: при 3000 об./мин в течение 10 мин центрифугировали 1 дм³ воды при температуре плюс 4 °C. Полученный осадок делили на три части: одну исследовали микроскопически после окрашивания по Романовскому, вторую высевали на питательные среды прямым посевом, третью инкубировали в тиогликолевой среде (среда накопления) с последующим высевом. Мембранная фильтрация: 3 дм³ воды фильтровали через аналитическую трековую мембрану (поры 2,5–3 мкм) и фильтр из нитрата целлюлозы (поры 0,45 мкм). С фильтров делали смывы, которые исследовали прямым посевом и после накопления в тиогликолевой среде.
Для предварительной оценки биологической природы взвесей использовали каталазный экспресс-тест по МР 4.2.0161–19⁴.
В работе использовали следующие питательные среды: мясо-пептонный МПА-агар, среда Эндо и среда Сабуро (все HiMedia, Индия), тиогликолевая среда, агар для барицелл, питательная среда для лактобацилл сухая (агар MRS) (все Conda, Испания), кровь баранья дефибринированная – Br и энтерококковый агар (все Россия).
Видовую идентификацию всех выросших на питательных средах изолированных колоний проводили методом матрично-активированной лазерной десорбции/ионизации с времяпролётным масс-анализатором (MALDI-TOF MS, Bruker, Германия). Идентификация считалась достоверной при значении коэффициента достоверности (SCORE) > 2 для вида и в диапазоне 1,7–2 для рода. Все этапы исследований проводили в соответствии с ГОСТ Р 70152–2022⁵. Осуществляли контроль стерильности оборудования, качества питательных сред с использованием контрольных штаммов микроорганизмов (E. coli ATCC 10536, P. aeruginosa ATCC 10145 и др.), а также санитарно-микробиологический контроль воздуха и поверхностей в рабочих помещениях.
Результаты
Определение нормируемых показателей. Результаты исследования по определению нормируемых показателей БГКП, E. coli, ОМЧ при температуре плюс 22 °C, ОМЧ при температуре плюс 37 °C, энтерококков, P. aeruginosa представлены в табл. 1.
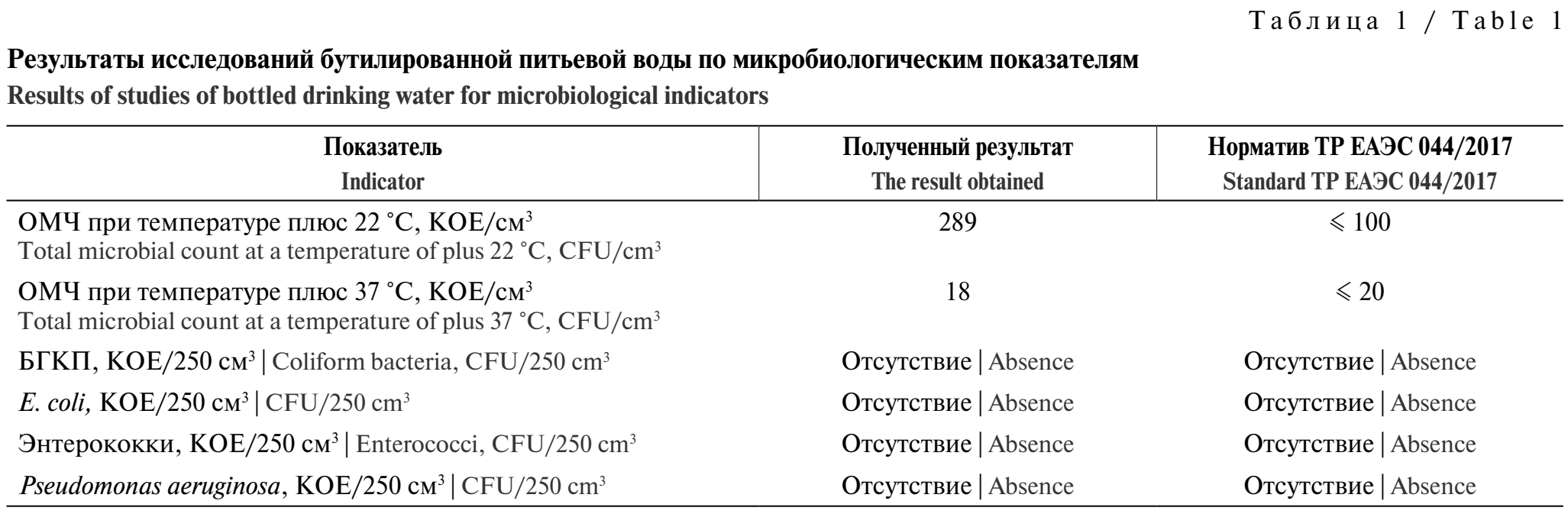
В результате исследования воды бутилированной питьевой в соответствии с ТР ЕАЭС 044/2017 нормируемые показатели БГКП, E. coli, энтерококки, P. aeruginosa не обнаружены. При определении показателя ОМЧ при температуре плюс 37 °С в 1 см³ исходной воды общее число выросших в толще агара микроорганизмов не превышало норматива. При определении показателя ОМЧ при температуре плюс 22 °С обнаружено количество микроорганизмов, в два раза превышающее норматив, но поскольку для природной питьевой воды в потребительской упаковке показатель ОМЧ определяется только в течение 12 ч после розлива, данный результат не может являться основанием для заключения о несоответствии качества воды на момент её производства.
В результате исследования бутилированной питьевой воды по МУК 4.2.2314–08 и МУК 4.2.3963–23 колифаги и паразитарные объекты не обнаружены.
Исследование взвесей (прозрачных матриксов). Визуальным и микроскопическим методами в исследуемой воде обнаружены прозрачные матриксы неизвестного происхождения. После концентрации проб воды объёмом 250 см³ на фильтре из нитрата целлюлозы проводили каталазный экспресс-тест. Положительный каталазный тест позволил предположить наличие каталазоположительных форм бактерий на исследуемой поверхности фильтра. Для определения состава биоплёнок после концентрации 1 л воды на центрифуге полученный осадок разделили на три части. Первую часть получившегося осадка окрашивали по Романовскому. При микроскопическом исследовании окрашенных препаратов осадка из воды обнаружены скопления клеток, характеризующиеся палочковидными бактериями цилиндрической формы и кокковой сборкой из нескольких микроорганизмов. Мицелий микромицетов не выявлен.
При посеве второй части осадка на питательные среды через сутки инкубации обнаружен рост бактерий Escherichia coli, Aquabacterium parvum на среде МПА и гриба Aspergillus fumigatus на средах МПА и MRS. На чашках, инкубированных в анаэробной станции, рост микроорганизмов не обнаружен.
При инкубации третьей части осадка в тиогликолевой среде в посеве из среды накопления обнаружен рост бактерий: Escherichia coli, Microbacterium testaceum на Бруцелл-агаре, Kocuria rhizophila, Micrococcus luteus на среде МПА, гриба Syncephalastrum racemosum на средах Бруцелл-агар и Сабуро. На чашках, инкубированных в анаэробной станции, рост микроорганизмов не обнаружен. Результаты исследований представлены в табл. 2.

Анализ 3 дм³ воды методом фильтрации подтвердил эти находки (табл. 3). В посевах с аналитической трековой мембраны обнаружен рост Escherichia coli (из среды накопления) на МПА, Br и MRS, Aspergillus fumigatus (из 0,9%-го изотонического раствора) на МПА и среде Сабуро и Syncephalastrum racemosum (из среды накопления) на среде Сабуро.
При посеве смывов с бактериального фильтра из нитрата целлюлозы на питательные среды обнаружен рост Aspergillus fumigatus (из 0,9%-го изотонического раствора) на МПА и среде Сабуро и Escherichia coli (из среды накопления) на МПА, Br и MRS. Важным результатом является повторное выделение E. coli из среды накопления. На чашках, инкубированных в анаэробной станции, рост микроорганизмов с аналитической трековой мембраны и с фильтра из нитрата целлюлозы не обнаружен. Результаты представлены в табл. 3.

Обсуждение
Согласно Техническому регламенту, показатель ОМЧ (общее микробное число) при температуре плюс 22 °C является технологическим нормативом и подлежит контролю исключительно производителем в течение 12 ч после розлива для подтверждения стабильности производственного процесса. Последующий рост мезофильной сапрофитной микрофлоры в бутилированной воде в процессе хранения является ожидаемым явлением и не регламентируется как показатель безопасности для готовой продукции на полке. Таким образом, выявленное превышение норматива по ОМЧ при температуре плюс 22 °С отражает естественную динамику микробиоты в упакованной воде.
Ключевыми для оценки безопасности подтверждёнными результатами остаются отсутствие в нормируемом объёме (250 см³) патогенных и индикаторных микроорганизмов (E. coli, БГКП, P. aeruginosa, энтерококки). Однако проведённое исследование демонстрирует ограниченность стандартного подхода к контролю бутилированной воды. Хотя анализ 250 см³ воды не выявил E. coli, её наличие установлено после концентрирования больших объёмов (1 и 3 дм³) и использования обогатительной среды. Следовательно, данный микроорганизм присутствовал в воде в виде локальных скоплений (взвесей), не улавливаемых при рутинном анализе. Обнаружение E. coli в питьевой воде, даже в малых количествах и в составе взвесей, значимо с эпидемиологической точки зрения, так как свидетельствует о фекальном загрязнении и потенциальном риске для потребителей, особенно с ослабленным иммунитетом [5].
В составе биоплёнки присутствовали условно патогенные бактерии и грибы:
- Escherichia coli, представитель кишечной микрофлоры человека и животных, – грамотрицательная каталазоположительная палочковидная бактерия, способная длительное время сохранятся в почве и в воде;
- Kocuria rhizophila – почвенная грамположительная каталазоположительная бактерия-сапрофит;
- Aquabacterium parvum – грамотрицательная каталазоотрицательная бактерия, входящая в состав биоплёнок;
- Micrococcus luteus – грамположительная каталазолположительная актинобактерия-сапрофит, широко распространённая в почве и воде;
- Microbacterium testaceum – эндофитная грамположительная бактерия, обитающая в растениях-хозяевах;
- Aspergillus fumigatus – плесневый гриб, один из наиболее распространённых в почве;
- Syncephalástrum racemosum – мукоровый гриб, распространённый в почвах субтропических регионов.
Это не единственный случай обнаружения биоплёнок в бутилированной питьевой воде. Так, в работе [30] показано, что в исследованной бутилированной воде биоплёнки представлены скоплением тонкого мицелия хемогетеротрофных микроорганизмов класса Actinobacteria. Авторами высказана гипотеза о негативной роли активированного угля, выступающего аккумулятором органических веществ, а также местом адгезии спор актинобактерий и бактериальных клеток [31, 32]. Дальнейшие исследования подтвердили, что гранулированный активированный уголь действительно служит ключевым «биореактором» и источником олиготрофной микрофлоры в системах подготовки воды [33].
Заключение
Проведённое комплексное исследование позволило сформулировать ряд принципиально важных выводов, имеющих значение для совершенствования системы контроля безопасности бутилированных питьевых вод. Продемонстрировано, что стандартизированные подходы, основанные на анализе фиксированных малых объёмов (до 250 см³), могут давать ложноотрицательные результаты при оценке микробиологической безопасности. В исследуемом образце Escherichia coli, ключевой индикатор фекальной контаминации, не обнаружена в 250 см³, но была однозначно идентифицирована после концентрирования объёмов 1 и 3 дм³ с последующим использованием тиогликолевой среды накопления. Это свидетельствует о неоднородном, кластерном распределении микроорганизмов в объёме продукции и наличии так называемой аналитической слепой зоны при рутинном контроле.
С помощью комплекса методов (каталазный тест, микроскопия, масс-спектрометрическая идентификация) удалось однозначно доказать, что прозрачные матриксы представляют собой не абиогенные частицы, а структурированные микробные ассоциации (бесплёночного типа), включающие как бактериальные, так и грибные компоненты. Выявленное биоразнообразие (Escherichia coli, Kocuria rhizophila, Micrococcus luteus, Aquabacterium parvum, Microbacterium testaceum, Aspergillus fumigatus, Syncephalastrum racemosum) указывает на возможность формирования в бутилированной воде сложных аутохтонных микробных ценозов, выполняющих функцию резервуара гигиенически значимых микроорганизмов.
Обнаружение в составе взвесей Escherichia coli является маркёром фекального загрязнения, указывающим на нарушения в системе обеспечения санитарно-технологической безопасности на одном из этапов производства. Данный факт трансформирует потенциальный риск в конкретную эпидемиологическую угрозу, прежде всего для групп населения с ослабленным иммунным статусом. Присутствие других изолятов, в частности грибов родов Aspergillus и Syncephalastrum, потенцирует риск за счёт возможной продукции микотоксинов и усиления устойчивости ассоциированных бактерий к воздействию неблагоприятных факторов.
Полученные данные убедительно доказывают, что для адекватной оценки микробиологических рисков, связанных с бутилированной водой, необходим двухуровневый подход:
- первый уровень – обязательный рутинный контроль по действующим нормативам;
- второй уровень – внедрение расширенных протоколов исследования при наличии визуальных отклонений (помутнение, взвеси, осадок).
В такие протоколы должны входить концентрирование репрезентативных объёмов воды (1–3 дм³) и использование методов, направленных на выявление повреждённых, некультивируемых и ассоциированных в биоплёнки клеток (накопительные среды, молекулярно-генетические методы).
Таким образом, результаты работы выявляют системную проблему в области методологии контроля. Дальнейшая разработка и нормативное закрепление алгоритмов расширенного микробиологического анализа для упакованных питьевых вод является актуальной задачей, направленной на минимизацию рисков для здоровья потребителей.
¹ГОСТ 34786–2021 «Вода питьевая. Методы определения общего числа микроорганизмов, колиформных бактерий, Escherichia coli, Pseudomonas aeruginosa и энтерококков».
²МУК 4.2.2314–08 «Методы санитарно-паразитологического анализа воды». Документ утверждён и введён в действие 18 января 2008 г. Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко.
³МУК 4.2.3963–23 «Бактериологические методы исследования воды», утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека 1 сентября 2023 г.
⁴МР 4.2.0161–19 «Методы индикации биологических плёнок микроорганизмов на абиотических объектах». Документ утверждён Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека 23 декабря 2019 г.
⁵ГОСТ Р 70152–2022 «Качество воды. Методы внутреннего лабораторного контроля качества проведения микробиологических и паразитологических исследований». Дата введения в действие: 1 января 2023 г.
Список литературы
1. Flemming H.C., Wingender J., Szewzyk U., Steinberg P., Rice S.A., Kjelleberg S. Biofilms: an emergent form of bacterial life. Nat. Rev. Microbiol. 2016; 14(9): 563–75. https://doi.org/10.1038/nrmicro.2016.94
2. Yin W., Wang Y., Liu L., He J. Biofilms: the microbial “protective clothing” in extreme environments. Int. J. Mol. Sci. 2019; 20(14): 3423. https://doi.org/10.3390/ijms20143423
3. Сыпачева Н.А., Сакаева Э.Х. Биопленки: структура, этапы формирования и методы борьбы. Химия. Экология. Урбанистика. 2024; 1: 119–23. https://elibrary.ru/nceump
4. Sharma D., Misba L., Khan A.U. Antibiotics versus biofilm: an emerging battleground in microbial communities. Antimicrob. Resist. Infect. Control. 2019; 8: 76. https://doi.org/10.1186/s13756-019-0533-3
5. Seviour T., Derlon N., Dueholm M.S., Flemming H.C., Girbal-Neuhauser E., Horn H., et al. Extracellular polymeric substances of biofilms: Suffering from an identity crisis. Water Res. 2019; 151: 1–7. https://doi.org/10.1016/j.watres.2018.11.020
6. Mossel D.A., Struijk C.B. Assessment of the microbial integrity, sensu G.S. Wilson, of piped and bottled drinking water in the condition as ingested. Int. J. Food Microbiol. 2004; 92(3): 375–90. https://doi.org/10.1016/j.ijfoodmicro.2003.08.015
7. Gholipour S., Shamsizadeh Z., Gwenzi W., Nikaeen M. The bacterial biofilm resistome in drinking water distribution systems: A systematic review. Chemosphere. 2023; 329: 138642. https://doi.org/10.1016/j.chemosphere.2023.138642
8. Loy A., Beisker W., Meier H. Diversity of bacteria growing in natural mineral water after bottling. Appl. Environ. Microbiol. 2005; 71(7): 3624–32. https://doi.org/10.1128/AEM.71.7.3624-3632.2005
9. Carraturo F., Del Giudice C., Compagnone M., Libralato G., Toscanesi M., Trifuoggi M., et al. Evaluation of microbial communities of bottled mineral waters and preliminary traceability analysis using NGS microbial fingerprints. Water. 2021; 13(20): 2824. https://doi.org/10.3390/w13202824
10. Byrne E., Schum S., Schaerer L., Techtmann S.M. Impacts of nutrients on alkene biodegradation rates and microbial community composition in enriched consortia from natural inocula. Microbiol. Spectr. 2023; 11(3): e0031622. https://doi.org/10.1128/spectrum.00316-22
11. Purohit A., Cochereau B., Sarkar O., Rova U., Christakopoulos P., Antonopoulou I., et al. Polyethylene biodegradation: A multifaceted approach. Biotechnol. Adv. 2025; 82: 108577. https://doi.org/10.1016/j.biotechadv.2025.108577
12. Curutiu C., Iordache F., Gurban P., Lazar V., Chifiriuc M.C. Main microbiological pollutants of bottled waters and beverages. In: Bottled and Packaged Water. Woodhead Publishing; 2019: 403–22. https://doi.org/10.1016/B978-0-12-815272-0.00014-3
13. Loy A., Beisker W., Meier H. Diversity of bacteria growing in natural mineral water after bottling. Appl. Environ. Microbiol. 2005; 71(7): 3624–32. https://doi.org/10.1128/AEM.71.7.3624-3632.2005
14. Lesaulnier C.C., Herbold C.W., Pelikan C., Berry D., Gérard C., Le Coz X., et al. Bottled aqua incognita: microbiota assembly and dissolved organic matter diversity in natural mineral waters. Microbiome. 2017; 5(1): 126. https://doi.org/10.1186/s40168-017-0344-9
15. Ma L., Jiang X.T., Guan L., Li B., Zhang T. Nationwide biogeography and health implications of bacterial communities in household drinking water. Water Res. 2022; 215: 118238. https://doi.org/10.1016/j.watres.2022.118238
16. Carniello V., Peterson B.W., van der Mei H.C., Busscher H.J. Physico-chemistry from initial bacterial adhesion to surface-programmed biofilm growth. Adv. Colloid Interface Sci. 2018; 261: 1–14. https://doi.org/10.1016/j.cis.2018.10.005
17. Shrestha S., Bista S., Byanjankar N., Prasai Joshi T. Evaluation of bottled drinking water and occurrence of multidrug-resistance and biofilm producing bacteria in Nepal. Environ. Pollut. 2024; 341: 122896. https://doi.org/10.1016/j.envpol.2023.122896
18. Greer H.M., Overton K., Ferguson M.A., Spain E.M., Darling L.E., Núñez M.E., et al. Extracellular polymeric substance protects some cells in an Escherichia coli biofilm from the biomechanical consequences of treatment with magainin 2. Microorganisms. 2021; 9(5): 976. https://doi.org/10.3390/microorganisms9050976
19. Немцева Н.В. Изучение образования биопленок в питьевой воде в процессе водоподготовки. Бюллетень Оренбургского научного центра УрО РАН. 2017; (2): 1. https://elibrary.ru/zeuman
20. Silva B.S., Furtado M.M., Freire L., Lee S., Jorge G.P., Daldosso G., et al. A large sampling study on the occurrence and characteristics of Pseudomonas aeruginosa and heterotrophic bacteria in mineral water over seasons and in different containers. Int. J. Food Microbiol. 2025; 443: 111427. https://doi.org/10.1016/j.ijfoodmicro.2025.111427
21. Simões L.C., Chaves A.F.A., Simões M., Lima N. Interactions between Penicillium brevicompactum/Penicillium expansum and Acinetobacter calcoaceticus isolated from drinking water in biofilm development and control. Int. J. Food Microbiol. 2023; 384: 109980. https://doi.org/10.1016/j.ijfoodmicro.2022.109980
22. Afonso T.B., Simões L.C., Lima N. Occurrence of filamentous fungi in drinking water: their role on fungal-bacterial biofilm formation. Res. Microbiol. 2021; 172(1): 103791. https://doi.org/10.1016/j.resmic.2020.11.002
23. Douterelo I., Fish K.E., Boxall J.B. Succession of bacterial and fungal communities within biofilms of a chlorinated drinking water distribution system. Water Res. 2018; 141: 74–85. https://doi.org/10.1016/j.watres.2018.04.058
24. Oliveira H.M., Santos C., Paterson R.R., Gusmão N.B., Lima N. Fungi from a groundwater-fed drinking water supply system in Brazil. Int. J. Environ. Res. Public Health. 2016; 13(3): 304. https://doi.org/10.3390/ijerph13030304
25. Fernandes S., Simões L.C., Lima N., Simões M. Adhesion of filamentous fungi isolated from drinking water under different process conditions. Water Res. 2019; 164: 114951. https://doi.org/10.1016/j.watres.2019.114951
26. Douterelo I., Fish K.E., Boxall J.B. Succession of bacterial and fungal communities within biofilms of a chlorinated drinking water distribution system. Water Res. 2018; 141: 74–85. https://doi.org/10.1016/j.watres.2018.04.058
27. Михайлова Р.И., Рыжова И.Н., Алексеева А.В., Каменецкая Д.Б., Кочеткова М.Г., Иксанова Т.И. Актуальные проблемы водообеспечения населения РФ. В кн.: Российская гигиена – развивая традиции, устремляемся в будущее. Материалы XII Всероссийского съезда гигиенистов и санитарных врачей. Том 1. М.; 2017: 294–7. https://elibrary.ru/ztzpnh
28. Синицына О.О., Хамидулина Х.Х., Турбинский В.В., Трухина Г.М., Башкетова Н.С., Гильденскиольд О.А. и др. Гигиеническое нормирование различных видов вод на современном этапе. Гигиена и санитария. 2022; 101(10): 1151–7. https://doi.org/10.47470/0016-9900-2022-101-10-1151-1157 https://elibrary.ru/erbcbg
29. Трухина Г.М., Ярославцева М.А., Дмитриева Н.А. Современные тенденции санитарной микробиологии в реализации санитарно-эпидемиологического надзора за безопасностью водных объектов. Здоровье населения и среда обитания – ЗНиСО. 2022; 30(10): 16–24. https://doi.org/10.35627/2219-5238/2022-30-10-16-24 https://elibrary.ru/jtlysk
30. Loy A., Beisker W., Meier H. Diversity of bacteria growing in natural mineral water after bottling. Appl. Environ. Microbiol. 2005; 71(7): 3624–32. https://doi.org/10.1128/AEM.71.7.3624-3632.2005
31. Burke M., Wells E., Larison C., Rao G., Bentley M.J., Linden Y.S., et al. Systematic review of microorganism removal performance by physiochemical water treatment technologies. Environ. Sci. Technol. 2025; 59(41): 21763–75. https://doi.org/10.1021/acs.est.4c03459
32. Литвиненко З.Н., Кондратьева Л.М. Формирование биопленок Actinobacteria при очистке подземных вод. Limnology and Freshwater Biology. 2024; (4): 986–91. https://doi.org/10.31951/2658-3518-2024-A-4-986 https://elibrary.ru/ipsair
33. França L., Lopéz-Lopéz A., Rosselló-Móra R., da Costa M.S. Microbial diversity and dynamics of a groundwater and a still bottled natural mineral water. Environ. Microbiol. 2015; 17(3): 577–93. https://doi.org/10.1111/1462-2920.12430
Об авторах
Анна Венидиктовна АлексееваРоссия
Канд. мед. наук, начальник отд. гигиены, ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: AAlekseeva@cspmz.ru
Анжелика Владимировна Загайнова
Россия
Канд. биол. наук, зав. лаб. микробиологии и паразитологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: AZagaynova@cspmz.ru
Юрий Анатольевич Рахманин
Россия
Доктор мед. наук, профессор, академик РАН, гл. науч. сотр. ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: awme@mail.ru
Ирина Валентиновна Курбатова
Россия
Ст. науч. сотр. лаб. микробиологии и паразитологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: IKurbatova@cspmz.ru
Екатерина Сергеевна Кравченко
Россия
Биолог лаб. микробиологии и паразитологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: EKravchenko@cspmz.ru
Николай Васильевич Русаков
Россия
Доктор мед. наук, профессор, академик РАН, вед. специалист ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: awme@mail.ru
Рецензия
Для цитирования:
Алексеева А.В., Загайнова А.В., Рахманин Ю.А., Курбатова И.В., Кравченко Е.С., Русаков Н.В. Научно-практическое значение расширенного микробиологического анализа плавающих взвесей (биоплёнок) в упакованной минеральной природной столовой питьевой воде. Гигиена и санитария. 2025;104(12):1582-1588. https://doi.org/10.47470/0016-9900-2025-104-12-1582-1588. EDN: jqrjsc
For citation:
Alekseeva A.V., Zagainova A.V., Rakhmanin Yu.A., Kurbatova I.V., Kravchenko E.S., Rusakov N.V. Scientific and practical significance of extended microbiological analysis of floating suspensions (biofilms) in packaged natural mineral table drinking water. Hygiene and Sanitation. 2025;104(12):1582-1588. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1582-1588. EDN: jqrjsc
JATS XML









































