Перейти к:
Влияние различных углеводных субстратов на антагонистическую активность пробиотических штаммов Lactobacillus paracasei и Bifidobacterium longum в отношении условных патогенов
https://doi.org/10.47470/0016-9900-2025-104-12-1604-1610
EDN: kqztph
Аннотация
Введение. Углеводы, в том числе пищевые сахара и пребиотические олиго- и полисахариды, могут влиять на функциональную активность пробиотических бактерий посредством модуляции их метаболических процессов. Важным свойством пребиотиков является селективная активация эндогенных защитных популяций микрофлоры кишечника, что способствует подавлению роста патогенных и условно патогенных микроорганизмов. При этом специфичность различных пребиотических добавок по отношению к определённым экзогенным пробиотическим микроорганизмам остаётся неясной. Пробиотики могут быть компонентом многих пищевых продуктов и БАД к пище, поэтому важно понимать, как различные питательные субстраты влияют на их метаболическую и функциональную активность. Это знание позволит разрабатывать более эффективные продукты и добавки для поддержания бактериального баланса кишечника. Исследования in vitro позволяют оценить влияние отдельных компонентов на пробиотические штаммы. В настоящей работе изучено влияние различных углеводных субстратов на антагонистическую активность экзогенных пробиотических штаммов Lactobacillus paracasei и Bifidobacterium longum в отношении ряда условно патогенных микроорганизмов.
Цель исследования – оценить влияние различных углеводных субстратов, в том числе пищевых сахаров и пребиотиков, на антагонистическую активность штаммов Lactobacillus paracasei и Bifidobacterium longum в отношении условно патогенных микроорганизмов.
Материалы и методы. Методом двухэтапного культивирования в условиях комбинированной системы изучена антагонистическая активность двух пробиотических штаммов в отношении семи патогенных микроорганизмов в присутствии девяти различных углеводных субстратов.
Результаты. Установлено, что пробиотические штаммы способны проявлять избирательные антагонистические свойства в отношении одного и того же патогена в зависимости от присутствия разных источников углеводов. Так, например, было выявлено, что лактоза и сахароза способствуют повышению степени антагонистической активности лактобактерий в отношении Staphylococcus aureus с умеренной на высокую относительно как безуглеводного, так и положительного контроля, содержащего глюкозу, а инулин и фруктоолигосахариды (ФОС) подавляют конкурентные свойства данного штамма относительно Pseudomonas aeruginosa. Исследуемый штамм Bifidobacterium longum проявляет умеренную антагонистическую активность в отношении E. coli и C. jejuni, однако некоторые субстраты (сахароза, маннит, инулин, хитозан) способны угнетать данное свойство. В то же время такие субстраты, как лактоза, мальтоза, сахароза, хитозан и N-ацетил-D-глюкозамин, способствуют повышению антагонистической активности с низкой до умеренной в отношении K. pneumoniae, P. aeruginosa и A. baumannii. На основании полученных данных можно предположить, что N-ацетил-D-глюкозамин (NAG), маннит, мальтоза и лактоза представляют интерес как субстраты, повышающие антагонистический потенциал исследуемых штаммов в отношении ряда условных патогенов in vitro.
Ограничения исследования. Не проводилось совместное культивирование пробиотических штаммов и не оценивалась зависимость антагонистической активности от концентрации субстрата. Кроме того, не моделировались условия желудочно-кишечного тракта, что ограничивает экстраполяцию результатов in vitro на реальные физиологические условия.
Заключение. Мы выявили существенное влияние углеводного компонента питательной среды на антагонистические свойства исследуемых пробиотических штаммов, что может в дальнейшем учитываться при разработке пробиотических композиций, синбиотиков или специализированных продуктов питания.
Соблюдение этических стандартов. Исследование не требует представления заключения комитета по биомедицинской этике или иных документов.
Участие авторов:
Калашникова И.Г. – концепция и дизайн исследования, сбор материала и обработка данных, проведение исследования, написание текста;
Некрасова А.И. – концепция и дизайн исследования, редактирование;
Грицюк О.В., Федец З.Е., Панькова М.Н. – проведение исследования, разработка методологии;
Загайнова А.В. – обеспечение исследования, администрирование проекта;
Жернов Ю.В., Макаров В.В. – определение концепции, привлечение финансирования, обеспечение исследования;
Юдин С.М. – привлечение финансирования, обеспечение исследования.
Все соавторы – утверждение окончательного варианта статьи, ответственность за целостность всех её частей.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Финансирование. Работа выполнена в рамках государственного задания № 388-00154-22-00 «Создание мицеллярных пробиотиков нового поколения для направленного изменения состава микробиоты человека при хронических неинфекционных заболеваниях».
Поступила: 02.10.2025 / Поступила после доработки: 24.11.2025 / Принята к печати: 02.12.2025 / Опубликована: 15.01.2026
Ключевые слова
Для цитирования:
Калашникова И.Г., Некрасова А.И., Грицюк О.В., Федец З.Е., Панькова М.Н., Загайнова А.В., Жернов Ю.В., Макаров В.В., Юдин С.М. Влияние различных углеводных субстратов на антагонистическую активность пробиотических штаммов Lactobacillus paracasei и Bifidobacterium longum в отношении условных патогенов. Гигиена и санитария. 2025;104(12):1604-1610. https://doi.org/10.47470/0016-9900-2025-104-12-1604-1610. EDN: kqztph
For citation:
Kalashnikova I.G., Nekrasova A.I., Gritsyuk O.V., Fedets Z.E., Pankova M.N., Zagainova A.V., Zhernov Yu.V., Makarov V.V., Yudin S.M. The effect of various carbohydrate sources on the antagonistic activity of probiotic strains Lactobacillus paracasei and Bifidobacterium longum against opportunistic intestinal pathogens. Hygiene and Sanitation. 2025;104(12):1604-1610. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1604-1610. EDN: kqztph
Введение
Микробиота кишечника играет ключевую роль в поддержании здоровья человека: участвует в формировании барьерной функции, метаболизме, синтезе витаминов и регуляции иммунного ответа [1]. Нарушение постоянного состава данного сообщества вследствие различных факторов ассоциировано со многими патологическими состояниями организма [2]. Антибиотикотерапия, несбалансированное питание с низким потреблением пищевых волокон и избыточным содержанием легкоусвояемых углеводов разрушают некоторые нормальные защитные системы микробиома кишечника, делая людей более восприимчивыми к инфицированию условно патогенными микроорганизмами [3]. В связи с этим существует необходимость восстановления здорового состояния бактериального сообщества желудочно-кишечного тракта. Наиболее распространённым в настоящее время способом коррекции дисбактериозов является применение пробиотических средств [4].
Пробиотические микроорганизмы определяются как живые непатогенные микроорганизмы – представители защитных групп нормального кишечного микробиоценоза здорового человека и природных симбиотических ассоциаций, поступающие в составе пищевой продукции для улучшения состава и биологической активности защитной микрофлоры кишечника человека (ТР ТС 021/2011). Различные штаммы Bifidobacterium и Lactobacillus давно зарекомендовали себя как оптимальные для коррекции дисбактериозов, поэтому по сей день входят в состав пробиотических препаратов, обогащённых и специализированных продуктов питания и биологически активных добавок [5, 6]. Одно из свойств данных пробиотических микроорганизмов – способность подавлять рост патогенных микроорганизмов посредством продукции органических кислот, бактериоцинов, конкуренции за субстраты и места адгезии, а также модуляции иммунного ответа хозяина. Предполагается, что пребиотики могут усилить данные механизмы [6]. Пребиотики – это пищевые ингредиенты, селективно используемые определёнными представителями кишечной микробиоты, которые способствуют их росту и активности, благотворно влияя на здоровье человека (СанПиН 2.3.2.1078–01). Взаимодействие пробиотиков и пребиотиков, известное как синбиотический эффект, может усиливать конкурентную активность пробиотических штаммов и их устойчивость в кишечной экосистеме (колонизационную резистентность), повышая эффективность функциональных продуктов и биодобавок [7–9]. Однако зачастую исследования сосредоточены на способности штаммов метаболизировать определённый пребиотический субстрат [10, 11], при этом влияние на функциональную активность, в том числе на конкурентные свойства, остаётся малоизученным. В данной работе мы попытались охарактеризовать способность пробиотических штаммов подавлять активность патогенной микрофлоры в присутствии различных углеводных субстратов (как углеводов, присутствующих в продуктах питания, так и известных пребиотиков). Наиболее распространёнными в настоящее время специфичными субстратами, показавшими эффективность в отношении родов Bifidobacterium и Lactobacillus, являются инулин и фруктоолигосахариды (ФОС) [12], поэтому мы исследовали их влияние. Они входят в состав детского и лечебно-профилактического питания, однако их избыточное потребление может сопровождаться дискомфортом со стороны ЖКТ [13]. Это подтверждает необходимость тщательного подбора пребиотических компонентов, стимулирующих преимущественно полезные популяции микробиоты кишечника, в том числе определённые виды лакто- и бифидобактерий, при этом не вызывающих побочных эффектов.
Таким образом, исследование направлено на изучение влияния различных углеводных субстратов на функциональную антагонистическую активность пробиотических микроорганизмов, получение экспериментальных данных для разработки продуктов питания, содержащих пробиотические бактерии, для поддержания оптимального состава и метаболической активности кишечной микрофлоры.
Материалы и методы
Штаммы и культивирование. Объектами исследования являлись пробиотические штаммы Lactobacillus paracasei subsp. paracasei 29н/21 VKM B-3711D и Bifidobacterium longum subsp. longum 202/21 VKM B-3717D, ранее выделенные из образцов микробиоты кишечника здоровых добровольцев и находящиеся в коллекции биобанка лаборатории микробиологии и паразитологии ФГБУ «ЦСП» ФМБА России. В качестве тест-объектов использовали штаммы условно патогенных микроорганизмов, представленные в табл. 1.
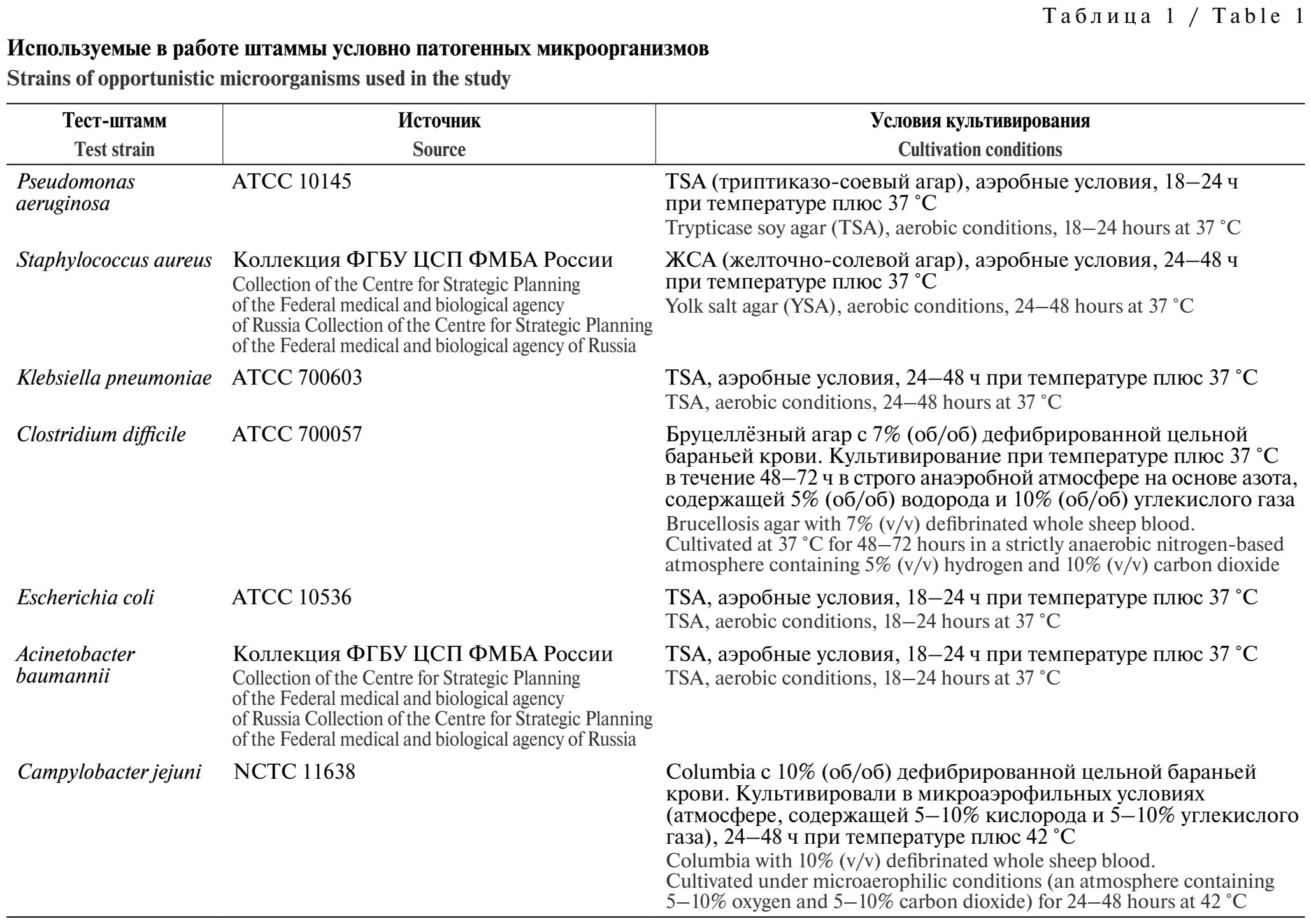
Для культивирования лакто- и бифидобактерий использовалась модифицированная агаризованная среда MRS (де Ман, Рогоза и Шарп) без глюкозы для исключения влияния стандартного углевода. Исследуемые субстраты (лактоза, инулин, N-ацетил-D-глюкозамин (NAG), хитозан, сахароза, ФОС, маннит, мальтоза) добавляли в количестве 20 г/л, предварительно стерильно фильтруя через мембранный фильтр. В качестве положительного контроля использовалась стандартная среда MRS (Condalab, Испания) с 20 г/л глюкозы, в качестве отрицательного – MRS без добавления углеводов. Условия культивирования тест-штаммов условно патогенных микроорганизмов представлены в табл. 1. Бактерии культивировали при температуре плюс 37–38 °С в течение 48–72 ч в соответствующих условиях (Lactobacillus – в атмосфере с 5% CO2; Bifidobacterium – в анаэробной атмосфере (газовая смесь 85% N2, 10% H2, 5% CO2).
Двухэтапное культивирование в условиях комбинированной системы. Для исследования антагонистической активности Lactobacillus paracasei subsp. paracasei 29н/21 VKM B-3711D и Bifidobacterium longum subsp. longum 202/21 VKM B-3717D использовали метод двухэтапного культивирования в условиях комбинированной системы (КСК), предложенный Сухиной М.А. и соавт. (RU 2670585 C1) [14, 15].
Построение комбинированной системы проводилось следующим образом. На стандартную чашку Петри диаметром 90 мм вливали 25 мл расплавленного MRS-агара, после застывания пластинку разрезали стерильным скальпелем по диаметру и удаляли одну половину. Освободившееся пространство заполняли агаром, предназначенным для культивирования тест-микроорганизмов, до высоты, равной толщине исходного слоя агара.
Первый этап. На половину чашки с MRS-агаром наносили 100 мкл суспензии пробиотического штамма с мутностью 1 McF (~ 3 · 10⁸ КОЕ/мл) и инкубировали 48 ч в соответствующих условиях (анаэробных или микроаэрофильных).
Второй этап. На противоположную половину чашки с соответствующей средой вносили 100 мкл суспензии тест-штамма с мутностью 1 McF (~ 3 · 10⁸ КОЕ/мл) и инкубировали 24–48 ч.
После инкубации измеряли зону задержки роста (мм) от края колонии пробиотического штамма перпендикулярно до фронта роста тест-культуры.
Оценка результата и анализ данных. Оценку результата проводили следующим образом: измеренная зона задержки роста тестируемой культуры длиной до 1 мм – отсутствие антагонистической активности, измеренная зона задержки роста тестируемой культуры длиной от 1 до 10 мм – низкая антагонистическая активность, измеренная зона задержки роста тестируемой культуры длиной от 11 до 29 мм – умеренная антагонистическая активность, измеренная зона задержки роста шириной от 30 до 45 мм – высокая антагонистическая активность. Все исследования проводили в трёх независимых повторностях. Данные обрабатывали в программе Microsoft Excel 2019 с вычислением среднего значения (M ± m); различия между вариантами считали статистически значимыми при p < 0,05 (t-критерий Стьюдента). Нормальность распределения данных определяли тестированием Шапиро – Уилка.
Результаты
По результатам определения антагонистистической активности методом двухэтапного культивирования микроорганизма-антагониста и пробиотической культуры в условиях комбинированной системы данные о размере зоны задержки роста ранжировали в зависимости от степени их антагонистической активности: высокая, средняя, низкая (см. рисунок на вклейке):
- < 1 мм – отсутствие активности;
- 1–10 мм – низкая;
- 11–29 мм – умеренная;
- 30–45 мм – высокая.
Представленные в табл. 2 результаты показывают, что исследуемый штамм Bifidobacterium longum проявляет умеренную антагонистическую активность в отношении E. coli и C. jejuni, однако некоторые субстраты (сахароза, маннит, инулин, хитозан) способны угнетать данное свойство. В то же время такие субстраты, как лактоза, мальтоза, сахароза хитозан и N-ацетил-D-глюкозамин, способствуют увеличению антагонистической активности с низкой до умеренной в отношении K. pneumoniae, P. aeruginosa и A. baumannii (p < 0,05 по сравнению с контролем). При этом инулин и ФОС снижали выраженность антагонистического эффекта для ряда тест-культур, что может быть связано с их метаболизацией сопутствующими микроорганизмами.
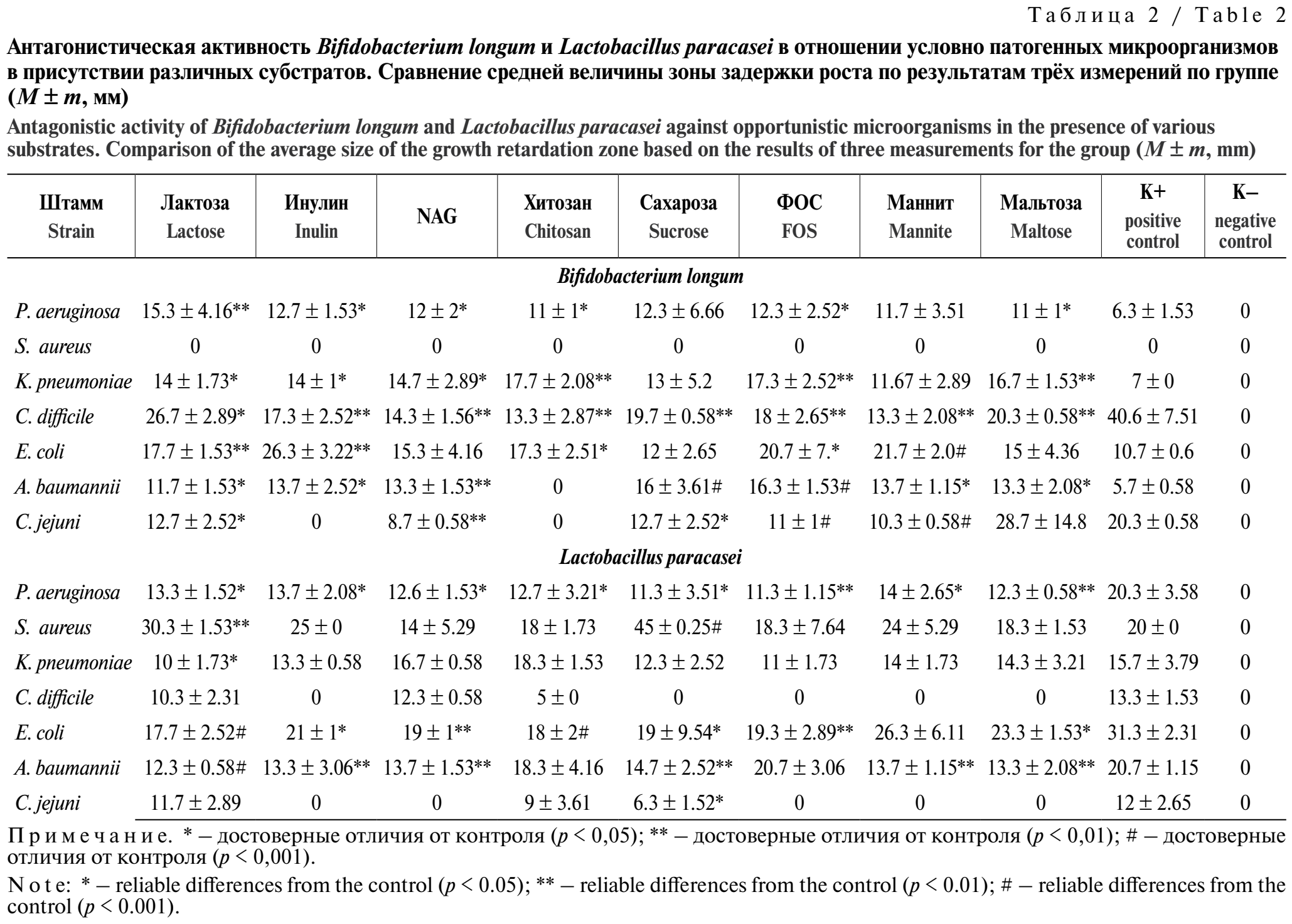
Результаты, представленные в табл. 2, наглядно демонстрируют, что используемые субстраты могут избирательно как способствовать улучшению антагонистической активности Lactobacillus paracasei (например, лактоза и сахароза в отношении S. aureus), так и угнетать данную функцию (инулин и ФОС в отношении P. aeruginosa, лактоза, глюкоза и N-ацетил-D-глюкозамин в отношении K. pneumoniae).
Также мы сравнили средние значения изменения зоны задержки роста попарно между субстратами. Результаты показывают статистически значимое влияние углеводного субстрата на уровень антагонистической активности пробиотических штаммов (p < 0,05). Основываясь на полученных данных в целом, можно заключить, что наибольший стимулирующий эффект наблюдался при использовании лактозы, NAG, маннита и мальтозы, улучшающих конкурентные свойства исследуемых Lactobacillus paracasei и Bifidobacterium longum. Таким образом, характер антагонистического взаимодействия зависит не только от вида пробиотического штамма, но и от специфики его метаболизма при использовании углеводного субстрата. Полученные данные демонстрируют, что для каждого сочетания «штамм – патоген» существует собственный профиль «полезных» и «нежелательных» углеводных субстратов. С точки зрения гигиены питания это означает, что при разработке продуктов с заявленным пробиотическим или синбиотическим эффектом недостаточно указать наличие пребиотика как класса веществ, а необходимо учитывать и его конкретное влияние на функциональную активность целевых штаммов.
Обсуждение
Считается, что модуляция здоровья экзогенными полезными бактериями в кишечнике осуществляется в том числе посредством двух механизмов: конкурентного исключения патогенов и (или) секреции метаболитов, которые могут влиять на физиологию хозяина [4, 16].
Результаты настоящего исследования демонстрируют, что тип углеводного субстрата влияет на антагонистическую активность пробиотических штаммов L. paracasei и B. longum в условиях in vitro, что согласуется с данными литературы о различиях в метаболизме углеводов у представителей рода Lactobacillus и Bifidobacterium [17]. В нашей работе лактоза, N-ацетил-D-глюкозамин, маннит и мальтоза в большинстве случаев усиливали антагонистические свойства исследуемых штаммов, что может быть связано с повышенной продукцией органических кислот и других низкомолекулярных метаболитов. Короткоцепочечные жирные кислоты (КЦЖК), лактат и ряд бактериоцинов относятся к важным медиаторам антагонизма и могут ограничивать рост условно патогенных бактерий за счёт снижения pH и специфического воздействия на клеточную стенку или метаболизм патогенов [17]. Полученные нами данные in vitro также согласуются с рядом ранее опубликованных работ, в которых изучалось влияние углеводных субстратов на метаболическую и антагонистическую активность пробиотических штаммов. Так, например, Valdés-Varela L. и соавт. (2016) показали, что четыре пробиотических штамма Bifidobacterium, культивируемые совместно с Clostridium difficile в присутствии различных углеводов, изменяли спектр продуцируемых метаболитов, что влияло на активность Clostridium difficile, однако эффект зависел от конкретного штамма: одни штаммы проявляли большие конкурентные свойства, другие не демонстрировали выраженного эффекта [18]. Аналогичным образом Natividad J.M. с соавт. установили, что изменение углеводного профиля в среде культивирования существенно модифицирует метаболический ответ штаммов Bifidobacterium, в том числе продукцию ацетата и лактата. При этом разные углеводы стимулировали различные метаболические пути, что обусловливало неодинаковую выраженность антагонизма in vitro [19]. Также, по данным Nagpal R. и соавт., лактоза и ФОС стимулировали продукцию молочной кислоты и усиливали подавление роста Escherichia coli и Staphylococcus aureus некоторыми пробиотическими штаммами Lactobacillus, однако инулин в ряде случаев не оказывал стимулирующего действия в экспериментах in vitro [20].
Антагонистическая активность пробиотических штаммов может быть обусловлена секрецией различных метаболитов, в том числе КЦЖК, а пребиотики могут влиять на спектр секретируемых метаболитов целевых штаммов [21–23]. Работы Rossi M. и соавт. [21] и Valdés-Varela L. и соавт. (2017) [22] показали, что различия в ферментации in vitro инулина и ФОС Bifidobacterium приводят к качественно отличающимся профилям КЦЖК, что напрямую связано с антагонистической активностью. Инулин в основном стимулировал образование бутирата, тогда как ФОС – ацетата и лактата [21], что может объяснять наблюдаемую нами разнонаправленность антагонистического эффекта. Это подчёркивает важность тщательного выбора наиболее подходящих штаммов, субстратов и их комбинаций при селекции кандидатных пробиотических микроорганизмов и производстве пробиотиков на их основе [18].
Исследования Tarrah A. и соавт. [10] и Kaoutari A.El. и соавт. [24] продемонстрировали, что способность штаммов Lactobacillus paracasei эффективно ферментировать определённые углеводы определяется набором углевод-активных ферментов (CAZyme). Это подтверждает необходимость индивидуального подбора углеводного субстрата с учётом генетических и метаболических особенностей конкретного пробиотического штамма начиная с исследований in silico.
В совокупности данные исследований подчёркивают, что углеводы не только служат источником энергии, но и являются регуляторами функциональной активности пробиотических микроорганизмов. Их влияние может проявляться через изменение pН среды, интенсивности ферментации, спектра метаболитов и продукции антагонистических соединений.
Исследования показали, что экзогенные пробиотические штаммы лакто- и бифидобактерий в сочетании со специально подобранным пребиотическим субстратом (так называемые синбиотики) имеют повышенный антагонистический потенциал в отношении ряда кишечных патогенов [3, 25, 26], что говорит о перспективности исследований, направленных на получение пробиотических штаммов с направленной эффективностью.
Поскольку жители индустриально развитых стран употребляют, как правило, недостаточное количество пищевых волокон, в клиническую практику врачей-диетологов и гастроэнтерологов вошло назначение пациентам с дисбактериозом пребиотических добавок. Также растёт количество представленных на рынке БАД и продуктов питания с добавлением пребиотиков, таких как инулин, ФОС, галактоолигосахариды (ГОС) и другие олиго- и полисахариды. Также в составе детского питания активно используются в качестве добавок ГОС и инулин [13]. Однако, как показали результаты настоящего исследования, стоит обратить внимание на то, что бактерии могут по-разному метаболизировать данные субстраты, что требует дополнительных исследований для создания наиболее эффективных композиций. Как и для всех функциональных пищевых ингредиентов, подтверждение пребиотического эффекта, полученного in vitro, должно быть показано в исследованиях in vivo с использованием проверенных методологий для получения надёжных научных данных.
Таким образом, полученные данные подтверждают целесообразность дальнейших исследований в области функциональной активности различных пробиотических микроорганизмов и их перекрёстных метаболических взаимодействий. Выбор пребиотического субстрата должен основываться не только на его способности стимулировать рост пробиотиков, но и на влиянии на функциональную активность конкретного штамма, в том числе продукцию антагонистических метаболитов. Экспериментальные данные in vitro, подобные полученным в настоящей работе, могут использоваться как первый этап обоснования состава специализированных продуктов и БАД, а также при планировании дальнейших доклинических и клинических исследований.
Ограничения исследования. Не проводилось совместное культивирование штаммов L. paracasei и B. longum, что могло бы отразиться на конкурентных свойствах и показать их взаимодействие в синбиотических системах. Также не было проведено исследование по подбору наиболее эффективной концентрации субстрата, что необходимо учитывать при дальнейшей разработке пробиотических формул. Кроме того, с учётом возможной повышенной конкурентной способности синбиотической композиции остаются неясными динамика ассимиляции пробиотических бактерий в желудочно-кишечном тракте и их влияние на популяционный баланс кишечной микробиоты.
Заключение
Вид углеводного питательного субстрата оказывает существенное влияние на метаболический профиль пробиотических штаммов L. paracasei и B. Longum и на их функциональную антагонистическую активность по отношению к кишечным патогенам.
Предварительное исследование in vitro функциональной активности экзогенных пробиотических штаммов и поиск способов модуляции их свойств, в том числе за счёт применения различных субстратов, в числе которых находятся и пребиотики, относятся к перспективным научно-практическим направлениям и требуют дополнительных исследований.
Сложные углеводы (поли- и олигосахариды, такие как инулин и ФОС) продемонстрировали более выраженный эффект в отношении антагонистической активности L. paracasei и B. longum по сравнению с моносахаридом (глюкоза), улучшая данную функцию у исследуемых штаммов.
Список литературы
1. Servin A.L. Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens. FEMS Microbiol. Rev. 2004; 28(4): 405–40. https://doi.org/10.1016/j.femsre.2004.01.003
2. Manor O., Dai C.L., Kornilov S.A., Smith B., Price N.D., Lovejoy J.C., et al. Health and disease markers correlate with gut microbiome composition across thousands of people. Nat. Commun. 2020; 11(1): 5206. https://doi.org/10.1038/s41467-020-18871-1
3. Hopkins M.J., Macfarlane G.T. Nondigestible oligosaccharides enhance bacterial colonization resistance against Clostridium difficile in vitro. Appl. Environ. Microbiol. 2003; 69(4): 1920–7. https://doi.org/10.1128/AEM.69.4.1920-1927.2003
4. Markowiak P., Śliżewska K. Effects of probiotics, prebiotics, and synbiotics on human health. Nutrients. 2017; 9(9): 1021. https://doi.org/10.3390/nu9091021
5. Van Hul M., Cani P.D., Petifils C., De Vos W.M., Tilg H., El Omar E.M. What defines a healthy gut microbiome? Gut. 2024; 73(11): 1893–908. https://doi.org/10.1136/gutjnl-2024-333378
6. Gurry T. Synbiotic approaches to human health and well-being. Microb. Biotechnol. 2017; 10(5): 1070–3. https://doi.org/10.1111/1751-7915.12789
7. Kok C.R., Gomez Quintero D.F., Niyirora C., Rose D., Li A., Hutkins R. An in vitro enrichment strategy for formulating synergistic synbiotics. Appl. Environ. Microbiol. 2019; 85(16): e01073–19. https://doi.org/10.1128/AEM.01073-19
8. Gomez Quintero D.F., Kok C.R., Hutkins R. The future of synbiotics: rational formulation and design. Front. Microbiol. 2022; 13: 919725. https://doi.org/10.3389/fmicb.2022.919725
9. Krumbeck J.A., Walter J., Hutkins R.W. Synbiotics for improved human health: recent developments, challenges, and opportunities. Annu. Rev. Food Sci. Technol. 2018; 9: 451–79. https://doi.org/10.1146/annurev-food-030117-012757
10. Tarrah A., Pakroo S., Lemos Junior W.J.F., Guerra A.F., Corich V., Giacomini A. Complete genome sequence and carbohydrates-active EnZymes (CAZymes) analysis of Lactobacillus paracasei DTA72, a potential probiotic strain with strong capability to use inulin. Curr. Microbiol. 2020; 77(10): 2867–75. https://doi.org/10.1007/s00284-020-02089-x
11. Fuhren J., Rösch C., Ten Napel M., Schols H.A., Kleerebezem M. Synbiotic matchmaking in Lactobacillus plantarum: substrate screening and gene-trait matching to characterize strain-specific carbohydrate utilization. Appl. Environ. Microbiol. 2020; 86(18): e01081–20. https://doi.org/10.1128/AEM.01081-20
12. Nagpal R., Kaur A. Synbiotic effect of various prebiotics on in vitro activities of probiotic lactobacilli. Ecol. Food Nutr. 2011; 50(1): 63–8. https://doi.org/10.1080/03670244.2011.539161
13. Шевелёва С.А., Маркова Ю.М., Sheveleva S.A., Markova Y.M. Безопасность и функциональный потенциал пробиотиков и пребиотиков, используемых в детском питании. Трудный пациент. 2022; 20(6): 22–38. https://elibrary.ru/wmqrrk
14. Сухина М.А., Жуховицкий В.Г., Шелыгин Ю.А. Cпособ оценки антагонистической активности лактобактерий толстокишечного биотопа пациента относительно разнообразных бактерий двухэтапным культивированием микроорганизма-антагониста и тестируемой культуры в условиях комбинированной системы. Патент РФ № 2670585 C1; 2018.
15. Сухина М.А., Бургасова О.А., Жуховицкий В.Г., Ющук Н.Д. Антагонистическая активность лактобацилл толстой кишки. Журнал микробиологии, эпидемиологии и иммунобиологии. 2012; 89(1): 41–9. https://elibrary.ru/pjnhwd
16. Gerritsen J., Smidt H., Rijkers G.T., de Vos W.M. Intestinal microbiota in human health and disease: the impact of probiotics. Genes Nutr. 2011; 6(3): 209–40. https://doi.org/10.1007/s12263-011-0229-7
17. Roberfroid M. Prebiotics: the concept revisited. J. Nutr. 2007; 137(3 Suppl. 2): 830S–7S. https://doi.org/10.1093/jn/137.3.830S
18. Valdés-Varela L., Hernández-Barranco A.M., Ruas-Madiedo P., Gueimonde M. Effect of bifidobacterium upon clostridium difficile growth and toxicity when co-cultured in different prebiotic substrates. Front. Microbiol. 2016; 7: 738. https://doi.org/10.3389/fmicb.2016.00738
19. Natividad J.M., Marsaux B., Rodenas C.L.G., Rytz A., Vandevijver G., Marzorati M., et al. Human milk oligosaccharides and lactose differentially affect infant gut microbiota and intestinal barrier in vitro. Nutrients. 2022; 14(12): 2546. https://doi.org/10.3390/nu14122546
20. Presti I., D’Orazio G., Labra M., La Ferla B., Mezzasalma V., Bizzaro G., et al. Evaluation of the probiotic properties of new Lactobacillus and Bifidobacterium strains and their in vitro effect. Appl. Microbiol. Biotechnol. 2015; 99(13): 5613–26. https://doi.org/10.1007/s00253-015-6482-8
21. Rossi M., Corradini C., Amaretti A., Nicolini M., Pompei A., Zanoni S., et al. Fermentation of fructooligosaccharides and inulin by bifidobacteria: a comparative study of pure and fecal cultures. Appl. Environ. Microbiol. 2005; 71(10): 6150–8. https://doi.org/10.1128/AEM.71.10.6150-6158.2005
22. Valdés-Varela L., Ruas-Madiedo P., Gueimonde M. In vitro fermentation of different fructo-oligosaccharides by Bifidobacterium strains for the selection of synbiotic combinations. Int. J. Food Microbiol. 2017; 242: 19–23. https://doi.org/10.1016/j.ijfoodmicro.2016.11.011
23. Miao M., Cheng J., Yan Q., Jiang Z., Yang S. Prebiotic activity comparison of eight oligosaccharides: selection of a potential synbiotic containing konjac manna-oligosaccharides and Bifidobacterium animalis BB-12. Int. J. Food Sci. Nutr. 2025; 76(4): 419–29. https://doi.org/10.1080/09637486.2025.2494148
24. El Kaoutari A., Armougom F., Gordon J.I., Raoult D., Henrissat B. The abundance and variety of carbohydrate-active enzymes in the human gut microbiota. Nat. Rev. Microbiol. 2013; 11(7): 497–504. https://doi.org/10.1038/nrmicro3050
25. Auclair J., Frappier M., Millette M. Lactobacillus acidophilus CL1285, Lactobacillus casei LBC80R, and Lactobacillus rhamnosus CLR2 (Bio-K+): characterization, manufacture, mechanisms of action, and quality control of a specific probiotic combination for primary prevention of Clostridium di. Clin. Infect. Dis. 2015; 60(Suppl. 2): S135–43. https://doi.org/10.1093/cid/civ179
26. Arslanoglu S., Moro G.E., Boehm G. Early supplementation of prebiotic oligosaccharides protects formula-fed infants against infections during the first 6 months of life. J. Nutr. 2007; 137(11): 2420–4. https://doi.org/10.1093/jn/137.11.2420
Об авторах
Ирина Григорьевна КалашниковаРоссия
Аналитик 2-й категории отд. медицинской геномики ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: IGKalashnikova@cspfmba.ru
Александра Игоревна Некрасова
Россия
Вед. аналитик категории отд. медицинской геномики ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: Akinshina@cspfmba.ru
Ольга Вячеславовна Грицюк
Россия
Канд. биол. наук, науч. сотр. лаб. микробиологии и паразитологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: Gritsyuk@cspmz.ru
Злата Евгеньевна Федец
Россия
Мл. науч. сотр. лаб. микробиологии и паразитологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
Марина Николаевна Панькова
Россия
Биолог лаб. микробиологии и паразитологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: MPankova@cspmz.ru
Анжелика Владимировна Загайнова
Россия
Канд. биол. наук, зав. лаб. микробиологии и паразитологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: AZagaynova@cspmz.ru
Юрий Владимирович Жернов
Россия
Доктор мед. наук, доцент, директор НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: YZhernov@cspfmba.ru
Валентин Владимирович Макаров
Россия
Канд. биол. наук, зам. директора по научно-экспериментальной работе ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: Makarov@cspfmba.ru
Сергей Михайлович Юдин
Россия
Доктор мед. наук, генеральный директор ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: yudin@cspmz.ru
Рецензия
Для цитирования:
Калашникова И.Г., Некрасова А.И., Грицюк О.В., Федец З.Е., Панькова М.Н., Загайнова А.В., Жернов Ю.В., Макаров В.В., Юдин С.М. Влияние различных углеводных субстратов на антагонистическую активность пробиотических штаммов Lactobacillus paracasei и Bifidobacterium longum в отношении условных патогенов. Гигиена и санитария. 2025;104(12):1604-1610. https://doi.org/10.47470/0016-9900-2025-104-12-1604-1610. EDN: kqztph
For citation:
Kalashnikova I.G., Nekrasova A.I., Gritsyuk O.V., Fedets Z.E., Pankova M.N., Zagainova A.V., Zhernov Yu.V., Makarov V.V., Yudin S.M. The effect of various carbohydrate sources on the antagonistic activity of probiotic strains Lactobacillus paracasei and Bifidobacterium longum against opportunistic intestinal pathogens. Hygiene and Sanitation. 2025;104(12):1604-1610. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1604-1610. EDN: kqztph
JATS XML









































