Перейти к:
Биохимические и иммунологические индикаторы чувствительности людей к запахам в модельных ольфактометрических исследованиях
https://doi.org/10.47470/0016-9900-2025-104-12-1618-1626
EDN: wxkoam
Аннотация
Введение. Метод динамической ольфактометрии с участием команды людей-панелистов был разработан для количественной оценки концентрации запаха в натурных пробах атмосферного воздуха и модельных образцах.
Цель работы – в модельном ольфактометрическом исследовании выбросов предприятий пищевой промышленности оценить информативность биохимических и иммунологических показателей слюны как возможных маркёров остроты обоняния человека.
Материалы и методы. Экспериментальная часть работы построена на использовании ольфактометра ECOMA T08, трёх пищевых одорантов с запахами апельсина, коньяка и кофе, стандартных методов оценки цитокинов ИЛ-1β, ИЛ-6, ИЛ-8, sIgA, NAG, α-амилазы и интенсивности ЛЗХЛ в пробах смешанной слюны. К исследованию были привлечены десять прошедших тестирование по н-бутанолу панелистов.
Результаты. Разработан алгоритм предобработки ольфактометрических данных, оптимальный для корреляционного анализа с молекулярными показателями слюны. Показано, что среди семи изученных маркёров слюны есть только один, ассоциированный с остротой обоняния человека в корреляционном тесте Спирмена: содержание ИЛ-8 (R = –0,392; p = 0,032 с порогами ощущения запаха и близкие к достоверным положительные связи с его воспринимаемой интенсивностью в объединённой матрице данных; N = 30). Расположение экспериментальных точек на соответствующих графиках позволяет предположить, что у здоровых людей с более острым обонянием имеются более гибкие механизмы выброса ИЛ-8 в ответ на провоцирующие изменения в составе микрофлоры полости рта, что ведёт к быстрому привлечению нейтрофилов из крови, снижению бактериальной колонизации и более эффективному связыванию молекул одоранта с обонятельными рецепторами в надэпителиальном мукозном слое.
Ограничения исследования. Небольшие размеры выборок, хотя и соответствующие практическим целям Европейского стандарта EN 13725.
Заключение. Метод динамической ольфактометрии, созданный как практический инструмент для оценки концентрации запаха в атмосферном воздухе, может также использоваться для изучения молекулярных механизмов обоняния.
Соблюдение этических стандартов. На проведение исследований было получено согласие локального этического комитета ФГБУ «ЦСП» ФМБА России (протокол № 3 от 17.08.2020 г.). Все участники дали информированное добровольное письменное согласие на участие в исследовании.
Участие авторов:
Хрипач Л.В. – концепция и дизайн исследования, определение биохимических и иммунологических показателей, написание текста;
Князева Т.Д. – определение биохимических и иммунологических показателей;
Андрюшин И.Б. – проведение ольфактометрии;
Бударина О.В. – концепция и дизайн исследования, редактирование.
Все соавторы – утверждение окончательного варианта статьи.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Финансирование. Исследование проведено в рамках выполнения Госзадания ФГБУ «ЦСП» ФМБА России.
Поступила: 16.10.2025 / Поступила после доработки: 19.11.2025 / Принята к печати: 02.12.2025 / Опубликована: 15.01.2026
Ключевые слова
Для цитирования:
Хрипач Л.В., Князева Т.Д., Андрюшин И.Б., Бударина О.В. Биохимические и иммунологические индикаторы чувствительности людей к запахам в модельных ольфактометрических исследованиях. Гигиена и санитария. 2025;104(12):1618-1626. https://doi.org/10.47470/0016-9900-2025-104-12-1618-1626. EDN: wxkoam
For citation:
Khripach L.V., Knyazeva T.D., Andryushin I.B., Budarina O.V. Biochemical and immunological indicators of human sensitivity to odors in model olfactometric studies. Hygiene and Sanitation. 2025;104(12):1618-1626. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1618-1626. EDN: wxkoam
Введение
До того как эпидемия COVID-19 выдвинула задачу изучения механизмов обоняния на передний план, эта область научных исследований прошла длинный, хотя и неторопливый путь. Он начался ещё в конце XIX века совместными усилиями физиологов и психологов, пытавшихся для начала хотя бы понять, насколько люди различаются по способности ощущать различные запахи и как можно эти различия оценить количественно. В результате были введены основные понятия, используемые в ольфактометрии и в настоящее время, – порог ощущения запаха, его воспринимаемая интенсивность, гедонический тон (приятно/неприятно), узнаваемость (familiarity) и др. [1–3]. Наряду с академическим исследовательским интересом и потребностями клинической ринологии это направление подпитывалось грантами крупных производителей парфюмерии, косметики, спиртных напитков, продуктов питания и других товаров, для которых привлекательный запах может стать причиной увеличения продаж.
Ольфактометрические методы, применявшиеся в этих исследованиях, были основаны преимущественно на использовании наборов флаконов или других ёмкостей с растворами различных одорантов. По мере развития направления самодельные наборы заменили на коммерческие с титрованными растворами определённых химических веществ [4–6]. В последние годы широкую известность, в том числе и в клинической практике, приобрёл разработанный в 1997 г. Sniffin’ Sticks Test (SST) – тест, в котором носители одорантов имеют вид фломастеров [3, 7–11].
В 80-х годах прошлого столетия в связи с развитием гигиены окружающей среды началась разработка унифицированных протоколов для количественной оценки интенсивности запаха в пробах атмосферного воздуха. Независимо от особенностей разрабатываемых протоколов все они были основаны на усреднении ощущений группы людей (так называемых панелистов), игравших роль живых датчиков наличия и силы запаха по причине отсутствия приборов, способных регистрировать сенсорные ощущения. Эти исследования проводились параллельно в Японии, США и Европе и закончились созданием двух разных стандартов измерения запаха газообразных смесей, в том числе проб атмосферного воздуха натурного происхождения.
Основные различия между этими стандартами заключаются в способе разведения изучаемых образцов чистым воздухом и выборе химических веществ для тестирования панелистов. В Японии, Китае и других азиатских странах для разработки национальных стандартов использовали Triangle (Triangular) Odor Bag Method [12–15], основанный на алгоритме сенсорного тестирования под названием forced-choice («вынужденный выбор из треугольника»). Аналогичный алгоритм вошёл также в объединённый Стандарт США ASTM E 679-04 для определения порогов запаха или вкуса [16]. Но основное отличие азиатского стандарта от европейского EN 13725 – статистический метод подготовки разведений исходной газовой смеси, при котором тестирование разных концентраций одоранта одной и той же группой панелистов разделено несколькими часами или даже сутками. Интересно, что отдельные элементы азиатского стандарта (в частности, перечень пяти определённых химических веществ для тестирования панелистов) вошли в отечественный ГОСТ для оценки запаха стройматериалов в воздухе замкнутых помещений [17], в то время как для оценки запаха атмосферного воздуха применяется европейский стандарт EN 13725 [18–21].
Европейский стандарт EN 13725 [22–24], утверждённый также в США и Австралии [25, 26], основан на использовании динамического ольфактометра и тестирования панелистов с помощью одного вещества – н-бутанола. Динамический ольфактометр обеспечивает быструю смену концентраций изучаемого вещества в подаваемой панелистам газовой смеси, автоматически изменяя соотношение исходного образца и чистого воздуха (рис. 1), и позволяет получать полную зависимость «концентрация – отклик» за один сеанс измерений. При этом основным критерием концентрации запаха в единицах запаха на м³ (European odour units per m³, ouE/m³) в стандарте EN 13725 является усреднённый порог его ощущения по результатам тестирования группой панелистов. Такие характеристики запаха, как воспринимаемая интенсивность, гедонический тон и др., рассматриваются как дополнительные, но не учитываются при расчёте концентрации запаха оцениваемой газовой смеси.
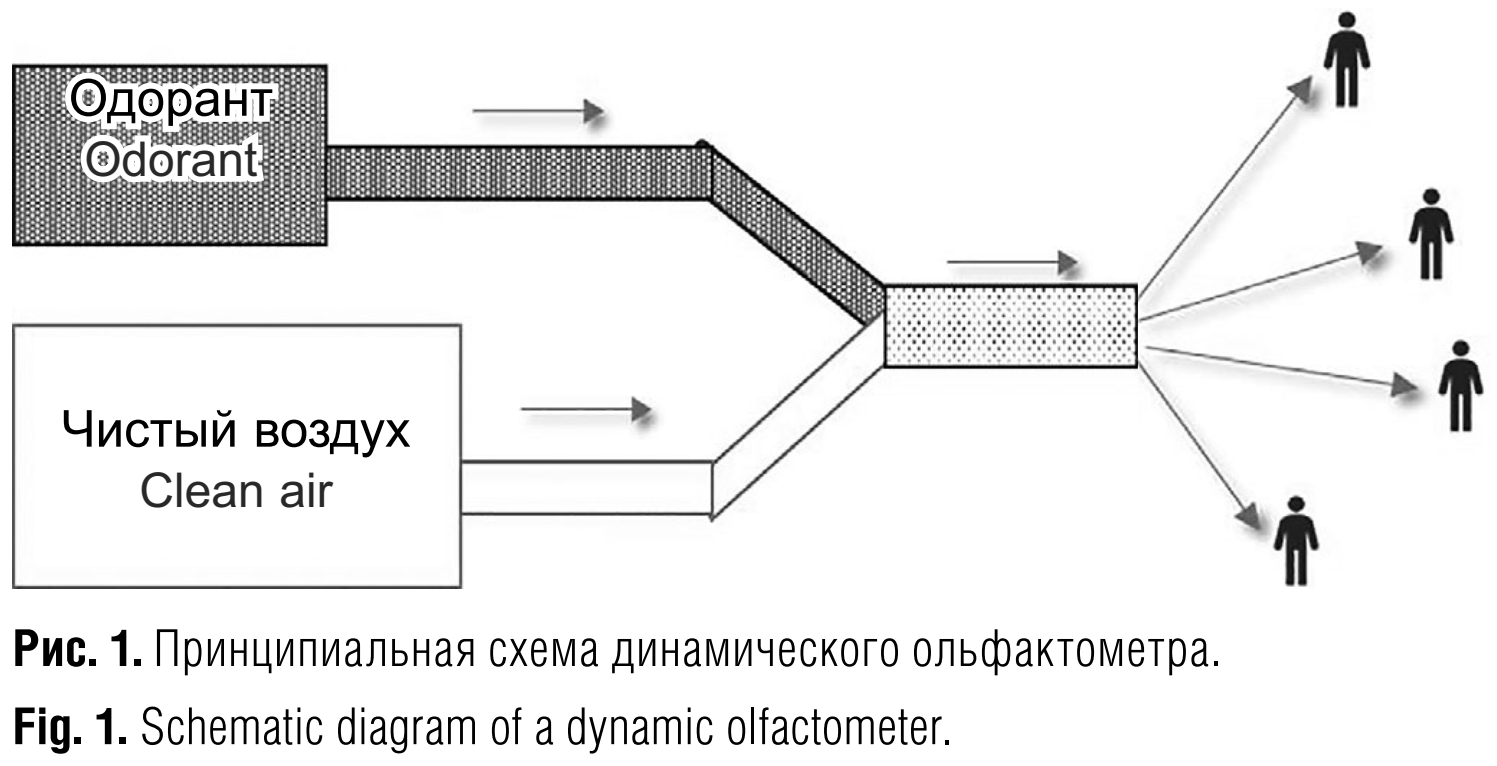
Большое внимание при разработке стандарта EN 13725 было уделено числу и составу групп панелистов, которые были бы оптимальными для решения практических задач гигиены окружающей среды [23, 27–30]. Исходно было очевидно, что группы по 30–50 и более человек, использовавшиеся обычно в работах физиологов, не отвечают соображениям бюджетности и быстроты обработки результатов. Рассматривались и другие крайние точки зрения. Например, было предложено уменьшить объём панели до 5 человек со сходными ольфактометрическими показателями, предварительно отобрав их из большой выборки. Это дало бы значительный выигрыш с точки зрения получения быстрых и стабильных результатов, но тем не менее в конце концов остановились на разумном консенсусе – из выборки претендентов на роль панелистов удалять только крайние варианты, то есть людей с аномально низкой или аномально высокой остротой обоняния, и установить N = 8 как минимальный объём панели для практических целей. При таком подходе обеспечивается репрезентативность населения, и выборка панелистов отражает различия по остроте обоняния в генеральной выборке.
Цель исследования – оценить информативность ряда биохимических и иммунологических показателей слюны как возможных маркёров остроты обоняния человека на примере модельного ольфактометрического исследования выбросов предприятий пищевой промышленности.
Эта цель возникла как следствие проведённого нами ранее обследования детей 5–7 лет, проживающих на разных расстояниях от комплекса предприятий пищевой промышленности – источника навязчивых запахов [31]. По данным анализа слюны 112 детей из шести детских садов было установлено, что достоверные корреляционные связи с расстояниями до промзоны имеют только показатели, отражающие активность взвешенных в слюне фагоцитов: интенсивность люминол-зависимой хемилюминесценции слюны, содержание в ней провоспалительных интерлейкинов ИЛ-1β и ИЛ-8 и активность лизосомального фермента N-ацетил-β-D-глюкозаминидазы. Был сделан вывод о наличии над территорией города градиента взвешенных частиц, концентрация которых в атмосферном воздухе увеличивается по мере приближения к источнику. Однако нельзя было полностью исключить вероятность того, что эти показатели изменялись не под влиянием взвешенных частиц, а в результате воздействия обладающих запахом компонентов выбросов на обонятельные рецепторы детей с последующей реакцией нейроэндокринной и вегетососудистой систем организма. Поэтому была организована серия модельных ольфактометрических экспериментов с использованием пищевых одорантов и параллельным определением в слюне участников тех же семи биохимических и иммунологических показателей, которые ранее применялись в обследовании детей. Как это подробно изложено в публикации [32], под влиянием запахов пищевых одорантов в слюне панелистов изменялся только один показатель – активность пищеварительного фермента α-амилазы, причём эти изменения определялись как достоверные только при объединении данных пяти отдельных экспериментов (n = 45). Таким образом, мы ответили на заданный практический вопрос, но разрабатываемое направление экспериментальных исследований позволяло также проверить, нет ли среди использовавшихся молекулярных показателей слюны маркёров остроты обоняния, имеющих достоверные коэффициенты корреляции с чувствительностью панелистов к запахам.
Материалы и методы
На проведение ольфактометрического исследования с участием людей получено согласие локального этического комитета ФГБУ «ЦСП» ФМБА России (протокол № 3 от 17.08.2020 г.). В состав участников включали некурящих лиц обоего пола, прошедших тестирование остроты обоняния по н-бутанолу. Всего были отобраны 10 человек (8 женщин и 2 мужчин) в возрасте от 26 до 62 лет (медиана и квартили 37 [32; 56] лет).
В работе использовали четырёхпортовый динамический ольфактометр ECOMA T08 (Германия), имеющий устройство ввода данных и компьютерное программное обеспечение для определения порогов обнаружения запаха тестируемого образца. Программное обеспечение ольфактометра исходит при этом из нажатий панелистами кнопок Yes/No (есть запах – нет запаха) в ответ на подаваемые смеси чистого воздуха с растущими концентрациями исходного образца одоранта. Для параллельной регистрации воспринимаемой интенсивности запаха мы использовали смешанный вариант проведения ольфактометрии – при каждой подаче одоранта на нюхательный порт участник нажимал кнопку Yes, если чувствовал запах, и одновременно записывал в личный протокол воспринимаемую им интенсивность запаха в баллах от 1 до 5.
В качестве модельных пищевых одорантов использовали апельсиновый и коньячный ароматизаторы промышленного производства и кофейный ароматизатор, приготовленный в лабораторных условиях из натурального растворимого кофе. Жидкий ароматизатор в количестве 1 мкл вводили микрошприцем в мешок из налофана объёмом 10 л, наполненный чистым воздухом. Содержание летучих компонентов ароматизатора в воздушной среде мешка определяли методом хромато-масс-спектрометрии на газовом хроматографе Agilent 7890A. Общее содержание определяемых органических веществ в воздушной среде налофановых мешков составляло 4,53; 3,57 и 2,94 мг/м³ для апельсинового, коньячного и кофейного ароматизаторов соответственно. Подробные сведения о спектрах летучих компонентов для каждого из ароматизаторов приведены в предыдущей публикации [32].
Эксперименты с разными одорантами проводили с недельным перерывом и одним и тем же составом панелистов. В каждом эксперименте участникам подавали две серии растущих концентраций летучих компонентов одоранта с шагом увеличения концентраций в два раза. Первая серия начиналась с неощутимых и заканчивалась пороговыми концентрациями, вторая – с неощутимой концентрации до максимально достижимой (с разведением 1 : 4). Время контакта участника с воздушной смесью на каждом шаге эксперимента составляло 3 с.
Пробы свободно вытекающей смешанной слюны отбирали у панелистов перед началом каждого эксперимента через 10 мин после полоскания полости рта питьевой водой. Отобранные пробы центрифугировали для удаления взвешенных клеток и хранили при температуре минус 24 °С. Содержание в слюне интерлейкинов ИЛ-1β, ИЛ-6, ИЛ-8 и секреторного иммуноглобулина А (sIgA) определяли методом твердофазного иммуноферментного анализа с использованием соответствующих тест-наборов ЗАО «Вектор-Бест», активность α-амилазы – с помощью клинических тест-наборов «Амилаза-Ново» того же производителя. Активность лизосомального фермента N-ацетил-β-D-глюкозаминидазы (NAG) измеряли по скорости отщепления п-нитрофенола от модельного субстрата 4-нитрофенил-N-ацетил-β-D-глюкозаминида [33], интенсивность люминол-зависимой хемилюминесценции (ЛЗХЛ) слюны – в среде инкубации, содержавшей 50 мкМ натриевой соли люминола, 50 мкл/мл слюны и 59 мМ перекиси водорода [34]. Математический анализ полученных данных проводили с помощью компьютерной программы Statistica for Windows (StatSoft) v. 7.0.
Результаты
Ольфактометрические показатели чувствительности обоняния участников. Индивидуальные пороги ощущения запаха рассчитывали программным обеспечением прибора по принятому в протоколе EN 13725 алгоритму как среднее геометрическое значение между первой опознанной и последней неопознанной концентрациями одоранта в подаваемом на нюхательный порт воздухе. Распределения этих величин были резко скошены влево как в отдельных экспериментах, так и в объединённой матрице данных (рис. 2, а), поэтому для дальнейшего анализа мы их логарифмировали по основанию натурального логарифма. Полученные распределения отличались от нормального, но предоставляли гораздо больше возможностей для графического анализа (рис. 2, б). Пороги ощущения запаха, определённые в первых (коротких) и вторых (длинных) сериях подачи разведений, были сходными с достоверным коэффициентом корреляции индивидуальных значений R = 0,595; р = 0,0007. Далее будут использованы пороги ощущения запаха, полученные в первых сериях разведений одорантов, специально предназначенных для этой цели.
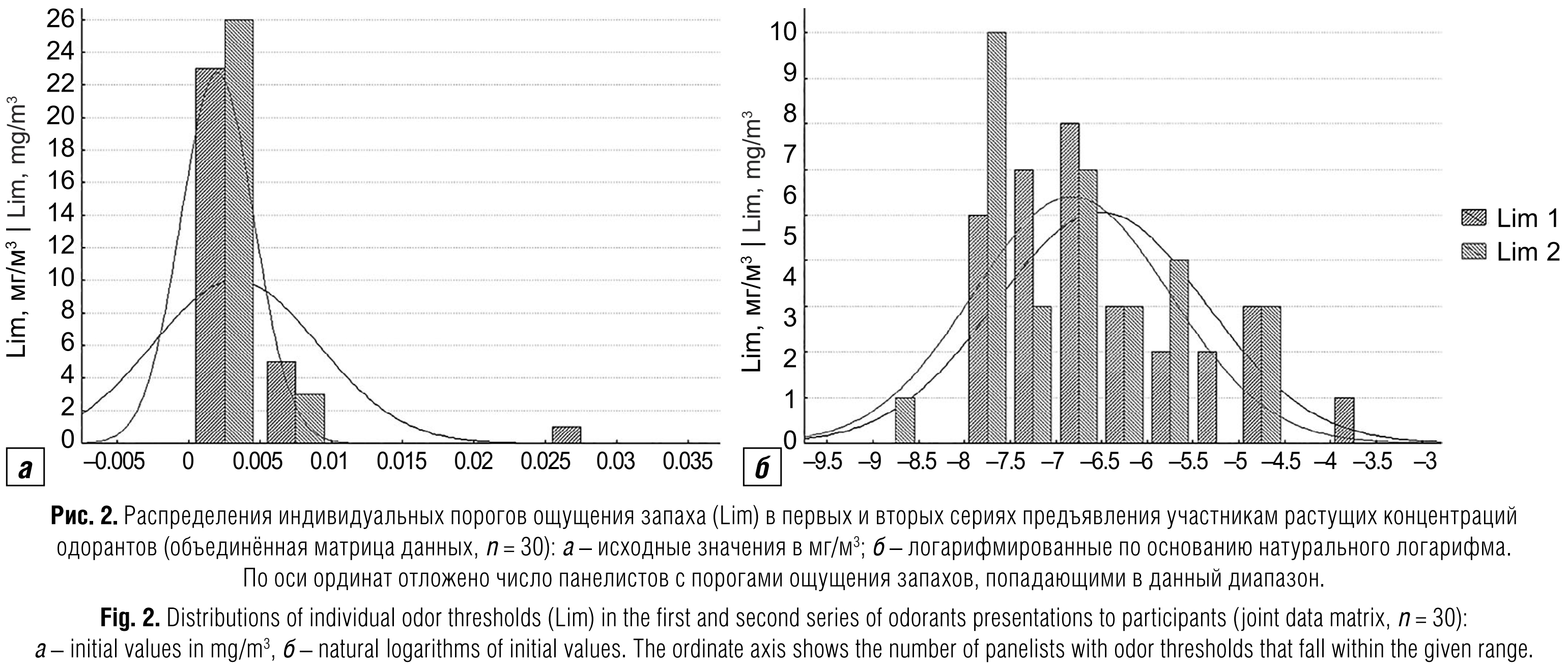
Воспринимаемую интенсивность запаха в баллах участники записывали при каждом подаваемом им разведении исходного образца, поэтому формально у нас был широкий выбор соотношений этих баллов для корреляционного анализа с молекулярными маркёрами слюны. Тем не менее эта широта выбора – кажущаяся. В начальной части каждой серии разведений компьютерная программа ольфактометра периодически вбрасывает на случайно выбранные нюхательные порты чистый воздух – по одному-два таких фальстарта на разведение. При этом независимо от того, правильно ли участник обнаружил фальстарт или приписал ему какое-то ненулевое значение интенсивности, он с точки зрения наших задач автоматически выпадает из ряда, поскольку сравнение участников по воспринимаемой интенсивности запаха должно проводиться при одной и той же концентрации одоранта. Кроме того, к концу второй (длинной) серии разведений начинает проявляться эффект сенсорного насыщения – всё больше участников выставляют интенсивности запаха максимальные баллы. Такие однобокие распределения (по 7–8 одинаковых оценок из 10) с корреляционным анализом несовместимы.
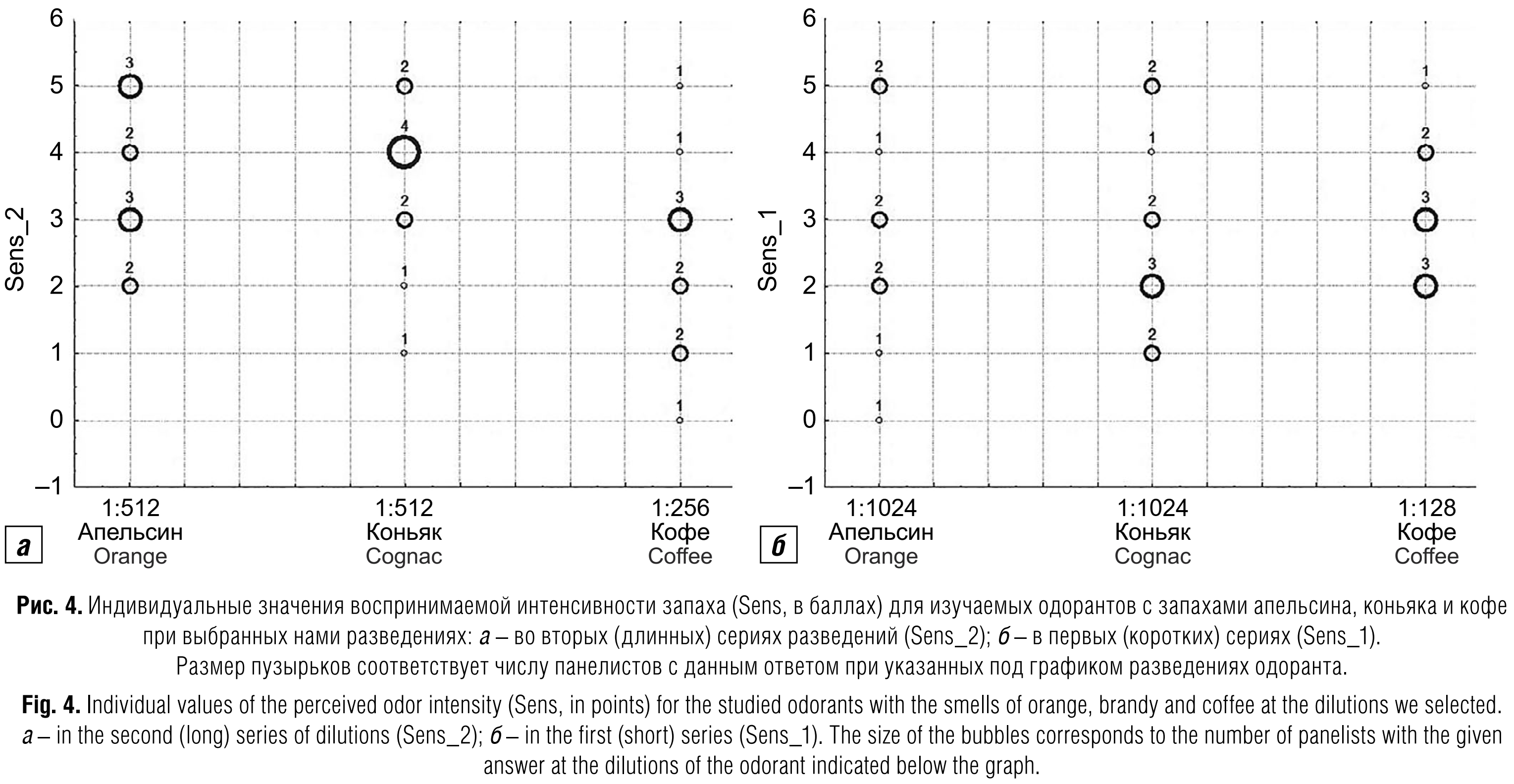
Во вторых (длинных) сериях разведений при выборе соотношений баллов, оптимальных для корреляционного анализа, мы исходили из двух условий: отсутствие фальстартов и как можно более широкий диапазон различий между индивидуальными оценками воспринимаемой интенсивности запаха (рис. 3; рис. 4, а).
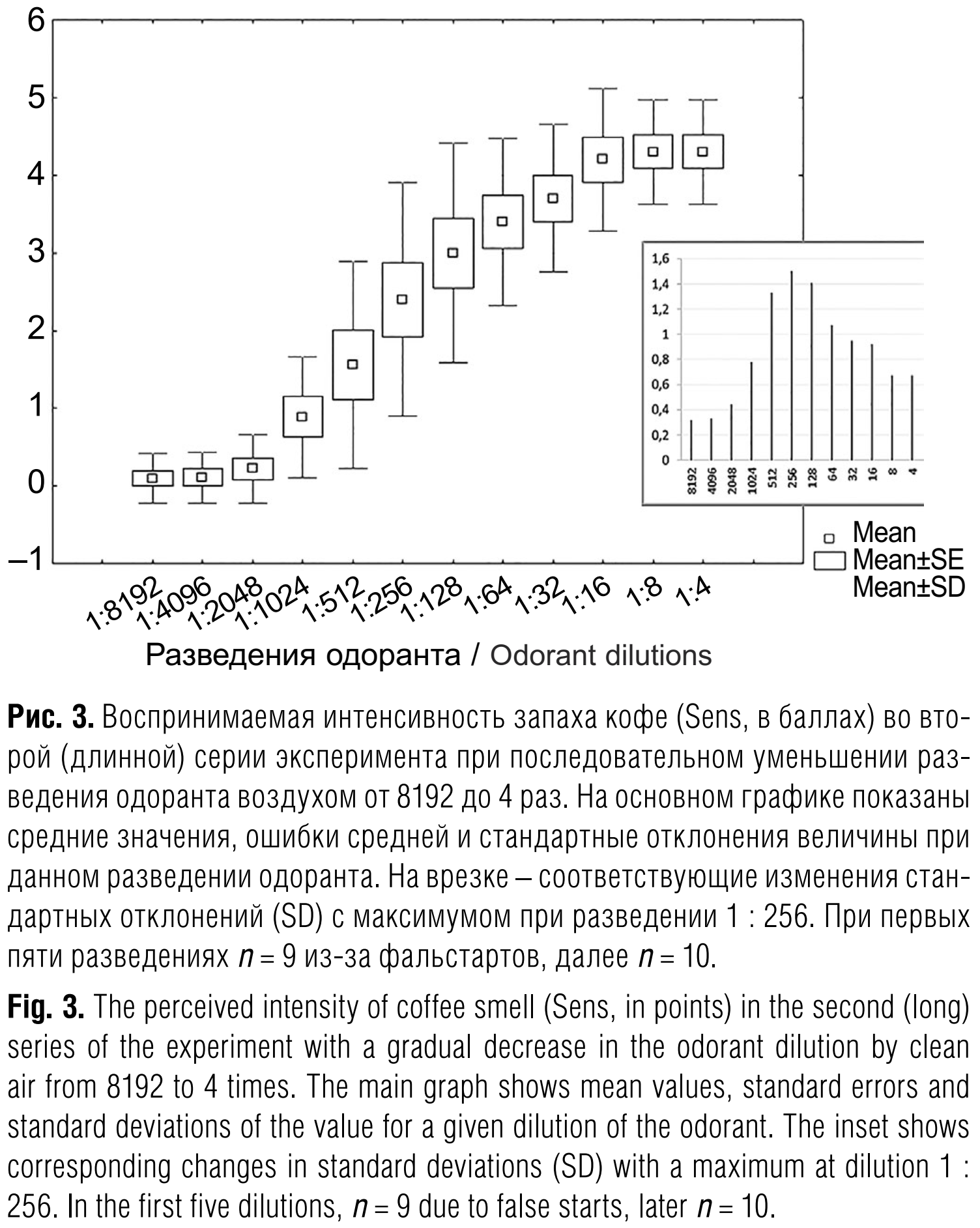
В первых (коротких) сериях экспериментов, предназначенных для определения порогов ощущения запаха, руководствоваться обоими вышеописанными принципами выбора оптимальных разведений не представлялось возможности не только из-за обилия фальстартов, но и из-за различий по длине серии для разных групп (четвёрок) участников (следующие разведения продолжают подаваться прибором, пока все четыре участника, тестируемые одновременно, не дойдут до своих пороговых величин). Поэтому мы просто выбрали разведения с максимально заполненными данными (рис. 4, б), в каждом из которых было по одному фальстарту. Интересно, что при этих условиях мы получили как бы зеркальный вариант графика на рис. 4, а. Тем не менее в обеих сериях диапазон баллов от 0 до 5 был перекрыт полностью со сходными распределениями в объединённой матрице данных (рис. 5, а) и достоверной корреляционной связью (R = 0,648; p = 0,0002) индивидуальных значений (рис. 5, б).
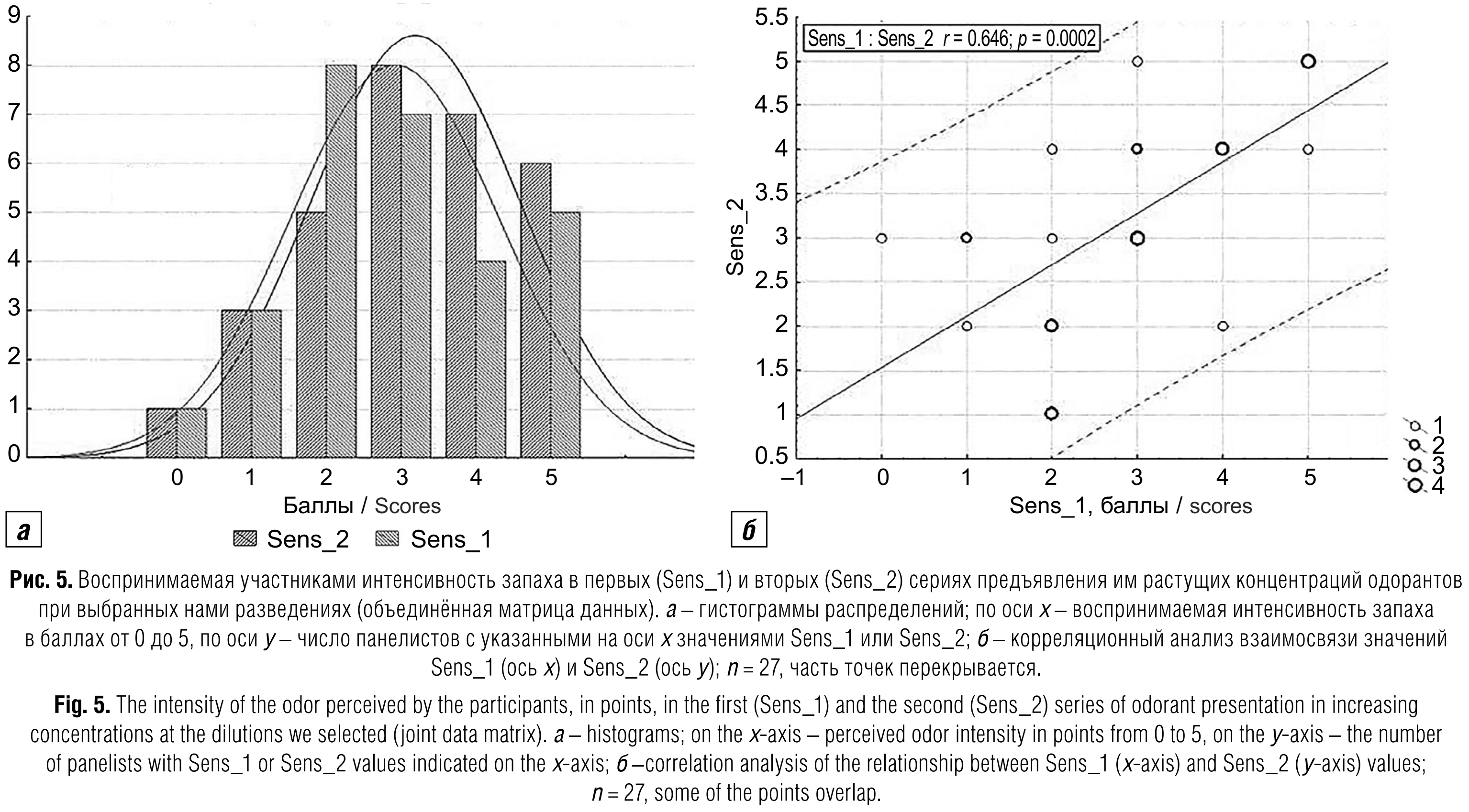
Анализ корреляционных связей между ольфактометрическими показателями чувствительности обоняния участников и молекулярными маркёрами состояния их слюны. Из всех определяемых нами биохимических и иммунологических показателей только интенсивность ЛЗХЛ слюны прошла тесты Колмогорова – Смирнова и Шапиро – Уилка на соответствие нормальному распределению. Все остальные маркёры имели распределения, в той или иной степени скошенные влево, и с учётом вышеописанных распределений ольфактометрических показателей для корреляционного анализа был выбран непараметрический тест Спирмена.
Как и в нашей предыдущей работе [32], где были найдены достоверные изменения одного из показателей под воздействием запахов только после объединения данных пяти отдельных экспериментов, достоверные корреляционные связи между чувствительностью обоняния участников и молекулярными маркёрами состояния их слюны были получены только в объединённой матрице данных (n = 30). Перед объединением данных трёх экспериментов в одну матрицу мы убедились, что между ними нет достоверных различий по изучаемым показателям слюны (теоретически недельный промежуток между опытами мог привести к сдвигу фоновых диапазонов, и тогда пришлось бы проводить двухфакторный анализ).
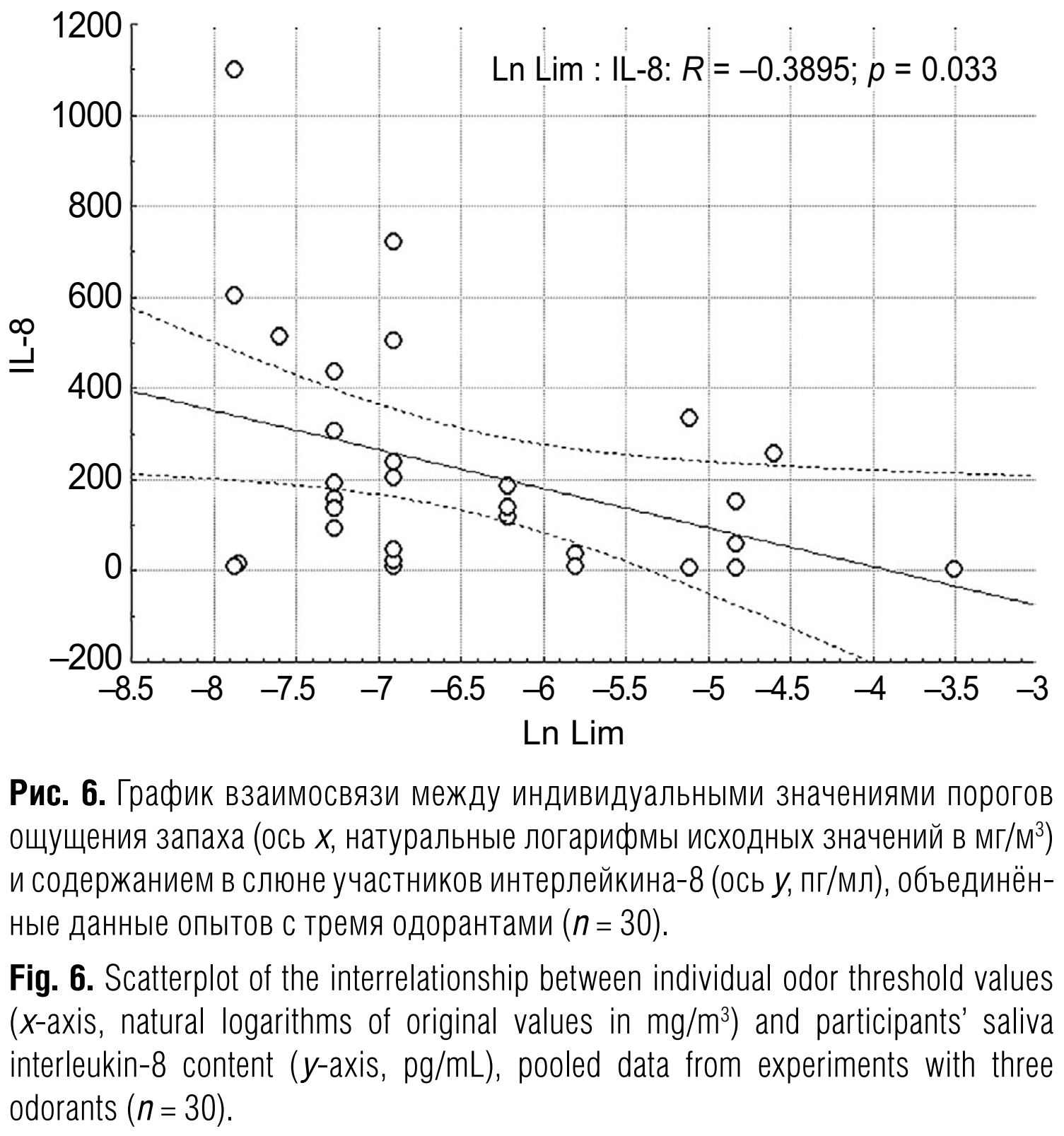
Из табл. 1 следует, что среди изучаемых нами семи показателей состава слюны есть только один, ассоциированный с остротой обоняния человека, – содержание интерлейкина ИЛ-8. Как это видно из табл. 1 и рис. 6, между значениями этого маркёра и порогами ощущения запаха имеется достоверная обратная связь, аппроксимируемая линейной зависимостью с R = –0,392; p = 0,032, согласно которой высокое содержание в слюне ИЛ-8 ассоциировано с низким порогом ощущения запахов (по крайней мере запахов пищевых одорантов), то есть с более острым обонянием.

С воспринимаемой интенсивностью запаха в баллах содержание в слюне ИЛ-8 имело более слабую связь, не достигшую принятой границы достоверности (р = 0,11 и р = 0,137 для первых и вторых серий предъявления участникам растущих концентраций одорантов), но имеющую ту же ассоциативную направленность – более высокие значения содержания в слюне ИЛ-8 ассоциированы с более высокими значениями воспринимаемой интенсивности изучаемых запахов, то есть с более острым обонянием.
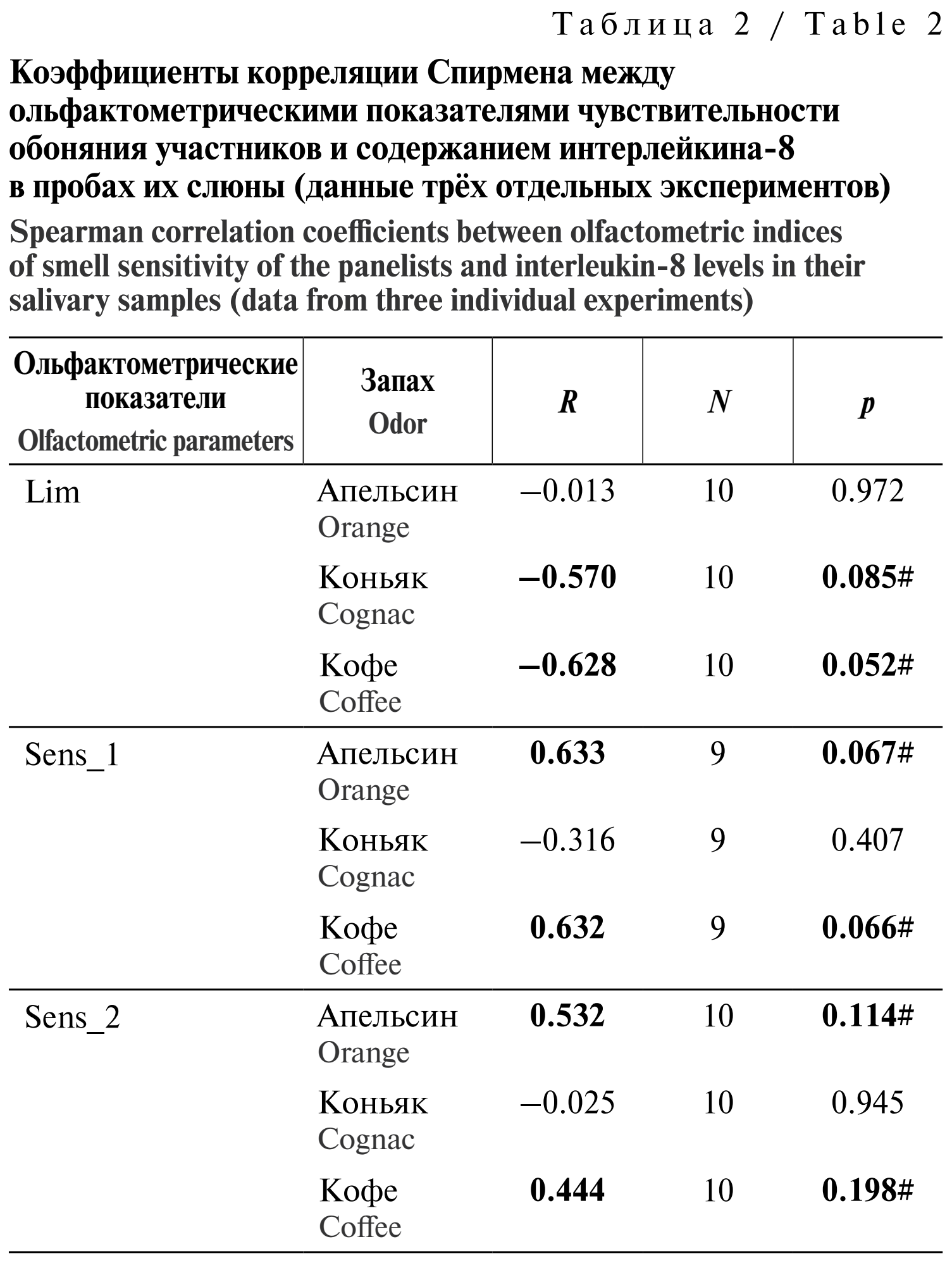
Двигаясь как бы назад по сравнению с обычным алгоритмом (сначала – отдельные подвыборки, затем – метаанализ), можно убедиться, что и в пределах отдельных экспериментов (табл. 2) видны близкие к достоверным коэффициенты корреляции между содержанием в слюне ИЛ-8 и чувствительностью панелистов к запахам. Таких значений 6 из 9, и при этом они имеют ту же смысловую направленность, что и в объединённой матрице данных с утроенным количеством объектов (см. табл. 1): повышенное содержание в слюне ИЛ-8 ассоциировано со снижением порогов ощущения запахов и увеличением их воспринимаемой интенсивности в надпороговой области, то есть с более острым обонянием. Как и в случае объединённой матрицы данных, ни один другой показатель слюны не имел достоверных или близких к достоверным корреляционных связей с чувствительностью панелистов к запахам апельсина, коньяка и кофе.
Важно отметить, что и с точки зрения результатов корреляционного анализа оценка воспринимаемой интенсивности запаха по данным первых и вторых серий разведений оказалась равнозначной, хотя нам и не удалось исходить в этих ситуациях из одних и тех же принципов. Теоретически это свидетельствует о том, что панелисты образуют некую ранговую структуру, в целом сохраняющуюся при повторе серий, практически – что при выборе оптимальных разведений одоранта можно и не искать максимальную величину дисперсии индивидуальных значений, достаточно придерживаться средней части концентрационной зависимости, где уже нет фальстартов и ещё не началось финальное выравнивание откликов.
Обсуждение
Ощущение запаха возникает при взаимодействии молекул одоранта с обонятельными рецепторами – специфическими белками на поверхности клеточных мембран обонятельных нейронов. Активированный обонятельный рецептор запускает в нейроне каскад биохимических реакций, приводящих к генерации нервного импульса, который затем передаётся в соответствующую область мозга. Представление о существовании обонятельных рецепторов сформировалось давно, но только в 2004 г. американские биологи Линда Бак и Ричард Эксел получили Нобелевскую премию за открытие семейства генов, кодирующих эти белки. Им оказалось обширное мультигенное семейство, представленное у людей почти тысячей генов, из которых экспрессируется менее половины.
Независимо от специфических механизмов ощущения запаха связывание одоранта с рецепторами обонятельных нейронов происходит на поверхности слизистой оболочки полости носа, состояние которой может влиять на чувствительность обоняния. Поэтому неудивительно, что цитокины [35–41], С-реактивный белок [41, 42], фибронектин [43] и другие участники адаптивных и воспалительных реакций периодически рассматривались как возможные кандидатуры на роль модуляторов ольфакторной чувствительности. Практически во всех этих работах ольфактометрические исследования проводились с помощью коммерческих вариантов Sniffin’ Sticks Test (SST), и в значительной их части вместо обычного твердофазного ИФА использовался мультиплексный анализ на микросферах, который позволял одномоментно определять 15–30 цитокинов и других сигнальных белков в минимальном объёме биологического материала.
В ряде работ показано, что содержание ИЛ-6 в плазме крови, слюне и назальном секрете (nasal mucus) пациентов с гипосмией достоверно увеличено по сравнению со здоровыми людьми [36, 37]; что степень снижения обоняния у больных хроническим риносинуситом ассоциирована с содержанием в назальном секрете ИЛ-5 (эозинофильного колониестимулирующего фактора) [38, 40, 44], а у пожилых американцев от 60 до 90 лет – с соотношением сывороточных цитокинов, характерным для «синдрома усталости» (IL-1Rahigh-IL-4low-IL-13low, то есть высокие уровни антагониста рецептора ИЛ-1 на фоне низких уровней ИЛ-4 и ИЛ-13) [41]. Чтобы установить влияние такой композиции, в рамках национального проекта NSHAP (The National Social Life, Health, and Aging Project) было проведено ольфактомерическое обследование более двух тысяч человек с мультиплексным анализом 18 цитокинов.
Интересующий нас провоспалительный цитокин ИЛ-8 определяли во многих работах, но связь с чувствительностью обоняния нашли только в одной [39] – в выборке 24 здоровых американцев, причём она оказалась обратной обнаруженной нами (рис. 7). Несмотря на визуальное сходство графиков 6 и 7, в том числе названий осей абсцисс, они свидетельствуют о противоположных эффектах, поскольку термином Combined Threshold на рис. 7 из статьи [39] обозначен результирующий балл Sniffin’ Sticks теста (число правильных ответов при рекурсивном изменении концентрации одоранта вверх-вниз), прямо пропорциональный остроте обоняния, а в нашей работе – порог ощущения запаха в мг/м³, обратно пропорциональный остроте обоняния.
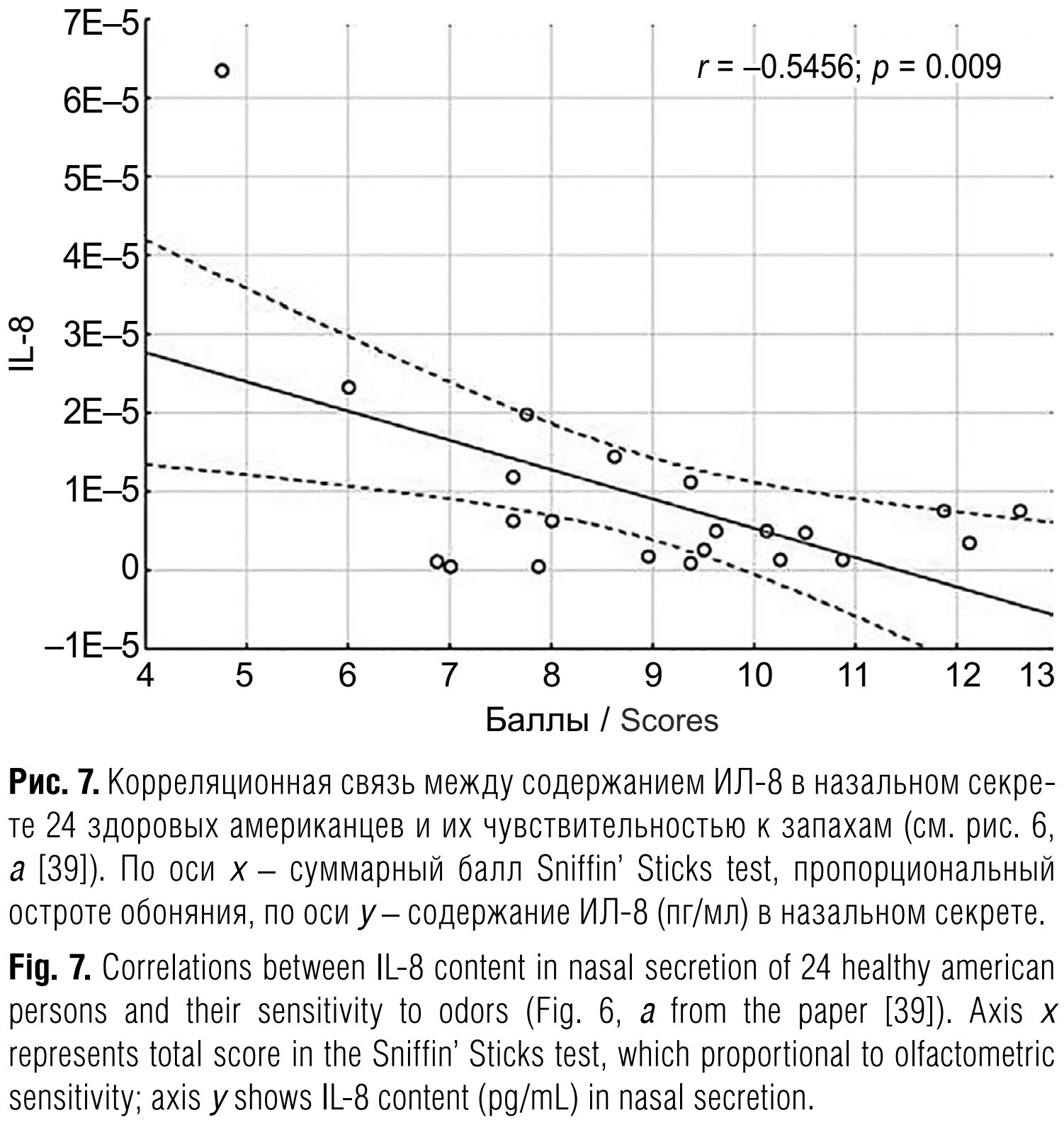
Вряд ли можно списать это противоречие на различия между назальным секретом и слюной, поскольку полости рта и носа анатомически не отделены друг от друга. Возможно, одной из причин являются небольшие объёмы выборок, из-за чего исходный материал приходится сливать в общие матрицы, внося дополнительную дисперсию. Мы получили достоверную связь только после объединения данных трёх опытов с разными запахами, авторы статьи [39] – только после объединения данных двух подвыборок, составленных из людей моложе 40 лет и людей старше 60. Таким образом, не исключено, что один из этих двух эффектов или они оба являются артефактами.
В то же время полученная нами ассоциативная связь вполне объяснима. ИЛ-8 – один из основных провоспалительных цитокинов, содержание которого в слюне, как и содержание ИЛ-1β, на два порядка выше, чем в сыворотке крови [45], что связано с присутствием в этой пограничной жидкости большого количества микрофлоры. ИЛ-8 образуется макрофагами, эпителиальными и эндотелиальными клетками, участвует в привлечении нейтрофилов к месту повреждения или инфекции в процессе, известном как хемотаксис. Формальная интерпретация графика на рис. 6 (чем больше порог ощущения запаха (хуже обоняние), тем ниже содержание ИЛ-8 в слюне и наоборот) относится не к расположению на нём экспериментальных точек, а к положению аппроксимирующей прямой. На самом деле низкие значения ИЛ-8, близкие к нулевым, видны на графике при любых значениях порогов ощущения запаха, и в целом расположение экспериментальных точек можно прочитать так: у людей с более острым обонянием содержание в слюне ИЛ-8 может принимать любые значения в широком диапазоне нормы, а у людей с более слабым – только относительно низкие. Поскольку слюна – это пограничная среда с быстрой сменой эпидемиологической обстановки, логично предположить, что у людей с более острым обонянием имеются более гибкие механизмы выброса ИЛ-8 в ответ на провоцирующие изменения в составе микрофлоры полости рта, а этот хемотаксический сигнал в свою очередь ведёт к привлечению дополнительного количества нейтрофилов из крови, снижению бактериальной колонизации и толщины надэпителиального мукозного слоя в полости рта и носа и, как отдалённый результат, – к более эффективному связыванию молекул одоранта с обонятельными рецепторами в области обонятельного эпителия.
Заключение
Проведённое нами исследование является пробным (и в какой-то степени побочным продуктом натурного гигиенического обследования детей). При анализе данных пришлось разрабатывать алгоритм оценки воспринимаемой интенсивности запаха, оптимальный для корреляционных тестов. Объём выборки панелистов (10 человек) соответствовал требованиям Европейского стандарта EN 13725, но, как показали наши результаты и их сравнение с работами других авторов, для изучения механизмов обоняния он слишком мал. Тем не менее полученные нами данные свидетельствуют о том, что метод динамической ольфактометрии, созданный как практический инструмент для оценки концентрации запахов в атмосферном воздухе, может использоваться и для изучения механизмов обоняния. В то же время следует учитывать, что динамические ольфактометры не относятся к бюджетному оборудованию, требуют специализированного помещения с приточной вентиляцией, имеют очень шумные моторы. Поэтому приобретать динамический ольфактометр для клинических целей или для изучения чувствительности людей к запахам не имеет смысла, но те учреждения гигиенического профиля, которые уже имеют это оборудование, могут с успехом использовать его параллельно для изучения молекулярных механизмов обоняния, кооперируясь с молекулярными биологами.
Список литературы
1. Moskowitz H.R., Dravnieks A., Klarman L.A. Odor intensity and pleasantness for a diverse set of odorants. Percept. Psychophys. 1976; 19(2): 122–8. https://doi.org/10.3758/BF03204218
2. Distel H., Ayabe-Kanamura S., Martínez-Gómez M., Schicker I., Kobayakawa T., Saito S., et al. Perception of everyday odors – correlation between intensity, familiarity and strength of hedonic judgement. Chem. Senses. 1999; 24(2): 191–9. https://doi.org/10.1093/chemse/24.2.191
3. de Lichtenberg Broge E.H., Wendin K., Rasmussen M.A., Bredie W.L. Familiarity and identification of everyday food odors in older adults and their influence on hedonic liking. Food Qual. Prefer. 2023; 103: 104715. https://doi.org/10.1016/j.foodqual.2022.104715
4. Hosoya K., Komachi T., Maeda Y., Akazawa H., Ogino E., Yoshida A., et al. Evaluation of odor recognition threshold measurement methods in T&T olfactometry: A survey study. Auris Nasus Larynx. 2024; 51(1): 61–8. https://doi.org/10.1016/j.anl.2023.07.009
5. Miwa T., Ikeda K., Ishibashi T., Kobayashi M., Kondo K., Matsuwaki Y., et al. Clinical practice guidelines for the management of olfactory dysfunction – secondary publication. Auris Nasus Larynx. 2019; 46(5): 653–62. https://doi.org/10.1016/j.anl.2023.07.009
6. Лопатин А.С., ред. Ольфакторная дисфункция. Российское общество ринологов. Практические рекомендации. М.; 2024.
7. Вахрушев С.Г., Смбатян А.С. Диагностическая ценность различных методов ольфактометрии. Российская оториноларингология. 2016; (3): 48–53. https://doi.org/10.18692/1810-4800-2016-3-48-53 https://elibrary.ru/waacuf
8. Алексеева Н.С., Пономарева Т.А. Диагностика нарушений обоняния с помощью Сниффин Стикс-теста при болезни Паркинсона и полипозном риносинусите. Вестник оториноларингологии. 2014; (1): 37–40. https://elibrary.ru/rwaosd
9. Rumeau C., Nguyen D.T., Jankowski R. How to assess olfactory performance with the Sniffin’ Sticks test. Eur. Ann. Otorhinolaryngol. Head Neck Dis. 2016; 133(3): 203–6. https://doi.org/10.1016/j.anorl.2015.08.004
10. Добрецов К.Г., Каширский Д.В. Изучение порога обоняния с помощью российской версии Сниффин Стикс теста. Российская ринология. 2024; 32(1): 6–10. https://doi.org/10.17116/rosrino2024320116 https://elibrary.ru/jaydqc
11. Sipos L., Galambosi Z., Bozóki S., Szadoczki Z. Statistical overview of the Sniffin’ sticks olfactory test from the perspectives of anosmia and hyposmia. Sci. Rep. 2025; 15(1): 8984. https://doi.org/10.1038/s41598-025-93380-z
12. Ministry of the Environment Government of Japan. Office of Odor, Noise and Vibration Environmental Management Bureau. Odor Index Regulation and Triangular Odor Bag Method. Available at: https://www.env.go.jp/en/air/odor/regulation/index.html
13. Nagata Y., Takeuchi N. Measurement of odor threshold by triangle odor bag method. Odor Measurement Review. 2003; 118: 118–27.
14. Wang Y., Shao L., Kang X., Zhang H., Lü F., He P. A critical review on odor measurement and prediction. J. Environ. Manag. 2023; 336: 117651. https://doi.org/10.1016/j.jenvman.2023.117651
15. Xu Y., Liang W., Hu Y. Methodological assessment of screening methods and minimum panel member requirements for odor assessments. Build. Environ. 2023; 237: 110326.
16. ASTM E679-91. Standard Practice for Determination of Odor and Taste Threshold By a Forced-Choice Ascending Concentration Series Method of Limits. American Society for Testing and Materials. Philadelphia, PA; 2004.
17. ГОСТ Р ИСО 16000-8-2015. Воздух замкнутых помещений. Часть 28. Определение выделения запаха строительными материалами с применением испытательных камер. М.: Стандартинформ; 2016.
18. ГОСТ Р 58578-2019. Правила установления нормативов и контроля выбросов запаха в атмосферу. М.: Стандартинформ; 2019.
19. Яценко-Хмелевская М.А., Цибульский В.В., Хитрина Н.Г., Короленко Л.И. Ольфактометрические исследования выбросов запаха на российских предприятиях. Биосфера. 2013; 5(3): 303–10. https://elibrary.ru/rdcisl
20. Бударина О.В., Сабирова З.Ф., Андрюшин И.Б., Шипулина З.В. Гигиеническое обоснование классификации опасности источников выбросов веществ, обладающих ольфакторным действием. Гигиена и санитария. 2023; 102(9): 888–95. https://doi.org/10.47470/0016-9900-2023-102-9-888-895 https://elibrary.ru/uyfatq
21. Кузьмин С.В., Бударина О.В., Рахманин Ю.А., Пинигин М.А., Додина Н.С., Сковронская С.А. Перспективы развития и гармонизации гигиенического нормирования с учётом риска возникновения запаха в атмосферном воздухе. Гигиена и санитария. 2024; 103(2): 96–103. https://doi.org/10.47470/0016-9900-2024-103-2-96-103 https://elibrary.ru/bvtxvx
22. European committee for standardisation. Air quality. Determination of odour concentration by dynamic olfactometry. European standard EN 13725:2003.
23. Harreveld A.P., Heeres P., Harssema H. A review of 20 years of standardization of odor concentration measurement by dynamic olfactometry in Europe. J. Air Waste Manag. Associat. 1999; 49(6): 705–15. https://doi.org/10.1080/10473289.1999.11499900
24. Harreveld A.P. Update on the revised EN 13725:2021. Chem. Engin. Transact. 2021; 85: 115–20. https://doi.org/10.3303/CET2185020
25. Mahin T. Measurement and regulation of odors in the USA. Odor Measurement Review. 2003; 62–8.
26. Department of Environmental Protection. Odour Methodology Guideline. Perth (Western Australia); 2002.
27. Leonardos G. Selection of panelists. J. Air Pollut. Control. Associat. 1980; 30(12): 1297–8.
28. Dravnieks A., Jarke F. Odor threshold measurement by dynamic olfactometry: significant operational variables. J. Air Pollut. Control. Associat. 1980; 30(12): 1284–9. https://doi.org/10.1080/00022470.1980.10465182
29. Clanton C.J., Schmidt D.R., Nicolai R.E., Goodrich P.R., Jacobson L.D., Janni K.A., et al. Dynamic olfactometry variability in determining odor dilutions-to-threshold. Transactions of the ASAE. 1999; 42(4): 1103–12.
30. Bhuker A., Maurya N.K. Selection and performance of sensory panelists: A comprehensive review of factors influencing sensory evaluation outcomes. J. Nutr. Food Process. 2024; 7(15). https://doi.org/0.31579/2637-8914/278
31. Хрипач Л.В., Князева Т.Д., Железняк Е.В., Маковецкая А.К., Коганова З.И., Бударина О.В. и др. Скрининг и пост-скрининг маркеров загрязнения атмосферного воздуха в пробах слюны детей дошкольного возраста. Гигиена и санитария. 2020; 99(6): 610–17. https://elibrary.ru/tuzauq
32. Хрипач Л.В., Бударина О.В., Князева Т.Д., Маковецкая А.К., Коганова З.И., Андрюшин И.Б. Биохимические и иммунологические показатели адаптивного ответа организма в ольфакто-одориметрических исследованиях. Гигиена и санитария. 2022; 101(7): 741–8. https://doi.org/10.47470/0016-9900-2022-101-7-741-748 https://elibrary.ru/diuxzm
33. Покровский А.А., Кравченко Л.В., Тутельян В.А. Влияние афлатоксина и митомицина С на активность лизосомальных ферментов. Биохимия. 1971; 36(4): 690–6.
34. Хрипач Л.В. Применение свободнорадикальных методов для оценки влияния полихлорированных диоксинов и фуранов на состояние здоровья населения. Гигиена и санитария. 2002; (2): 72–6.
35. Sultan B., May L.A., Lane A.P. The role of TNF-α in inflammatory olfactory loss. Laryngoscope. 2011; 121(11): 2481–6. https://doi.org/10.1002/lary.22190
36. Henkin R.I., Schmidt L., Velicu I. Interleukin 6 in hyposmia. JAMA Otolaryngol. Head Neck Surg. 2013; 139(7): 728–34. https://doi.org/10.1001/jamaoto.2013.3392
37. Aboelenin A.Y., Elsawy M.F., Hassan A.A., Qotb M.M., Hegab A., Aboelmaaty A.R. Correlation between Interleukin-6 serum level and olfactory dysfunction severity in COVID-19 patients in Egypt. Int. J. Med. Arts. 2024; 6(1): 4069–76.
38. Schlosser R.J., Mulligan J.K., Hyer J.M., Karnezis T.T., Gudis D.A., Soler Z.M. Mucous cytokine levels in chronic rhinosinusitis-associated olfactory loss. JAMA Otolaryngol. Head Neck Surg. 2016; 142(8): 731–7.
39. Wang H., Jaen C., Yoshikawa K., Haneoka M., Saito N., Nakamura J., et al. Cytokine profile in human olfactory cleft mucus and associated changes in olfactory function. BioRxiv. 2018; 332395.
40. Wu J., Chandra R.K., Li P., Hull B.P., Turner J.H. Olfactory and middle meatal cytokine levels correlate with olfactory function in chronic rhinosinusitis. Laryngoscope. 2018; 128(9): E304–10. https://doi.org/10.1002/lary.27112
41. Darnell E.P., Wroblewski K.E., Pagel K.L., Kern D.W., McClintock M.K., Pinto J.M. IL-1Rahigh-IL-4low-IL-13low: A novel plasma cytokine signature associated with olfactory dysfunction in older US adults. Chem. Senses. 2020; 45(5): 407–14. https://doi.org/10.1093/chemse/bjaa029
42. Ekström I., Vetrano D.L., Papenberg G., Laukka E.J. Serum C-reactive protein is negatively associated with olfactory identification ability in older adults. i-Perception. 2021; 12(2): 20416695211009928. https://doi.org/10.1177/20416695211009928
43. Chapman S., Kondo K., Ihara S., Ijichi C., SatoK., Touhara K. Fibronectin in the olfactory mucus increases sensitivity of olfactory receptor response to odorants. Sci. Adv. 2025; 11(20): eadu7271. https://doi.org/10.1126/sciadv.adu7271
44. Cavaliere C., Incorvaia C., Frati F., Messineo D., Ciotti M., Greco A., et al. Recovery of smell sense loss by mepolizumab in a patient allergic to dermatophagoides and affected by chronic rhinosinusitis with nasal polyps. Clin. Mol. Allergy. 2019; 17: 3. https://doi.org/10.1186/s12948-019-0106-2
45. Byrne M.L., O’Brien-Simpson N.M., Reynolds E.C., Walsh K.A., Laughton K., Waloszek J.M., et al. Acute phase protein and cytokine levels in serum and saliva: a comparison of detectable levels and correlations in a depressed and healthy adolescent sample. Brain Behav. Immun. Health. 2013; 34: 164–75. https://doi.org/10.1016/j.bbi.2013.08.010
Об авторах
Людмила Васильевна ХрипачРоссия
Доктор биол. наук, вед. науч. сотр. отд. профилактической токсикологии и медико-биологических исследований ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: LKhripach@cspfmba.ru
Татьяна Дмитриевна Князева
Россия
Канд. биол. наук, вед. биолог, сотр. отд. профилактической токсикологии и медико-биологических исследований ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
Илья Борисович Андрюшин
Россия
Инженер АО «Микрон», 124460, Москва, Россия
Ольга Викторовна Бударина
Россия
Доктор мед. наук, гл. науч. сотр. отд. анализа риска здоровью населения ФБУН «ФНЦГ им. Ф.Ф. Эрисмана» Роспотребнадзора, 141014, Мытищи, Россия
Рецензия
Для цитирования:
Хрипач Л.В., Князева Т.Д., Андрюшин И.Б., Бударина О.В. Биохимические и иммунологические индикаторы чувствительности людей к запахам в модельных ольфактометрических исследованиях. Гигиена и санитария. 2025;104(12):1618-1626. https://doi.org/10.47470/0016-9900-2025-104-12-1618-1626. EDN: wxkoam
For citation:
Khripach L.V., Knyazeva T.D., Andryushin I.B., Budarina O.V. Biochemical and immunological indicators of human sensitivity to odors in model olfactometric studies. Hygiene and Sanitation. 2025;104(12):1618-1626. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1618-1626. EDN: wxkoam
JATS XML









































