Перейти к:
Сравнительная оценка эффективности сорбции вирусов из воды на картриджном фильтре со стекловолокном и методов концентрирования, рекомендованных нормативными документами
https://doi.org/10.47470/0016-9900-2025-104-12-1764-1771
EDN: hwgtsa
Аннотация
Введение. Питьевая вода относится к важным стратегическим ресурсам. Мониторинг эпидемической безопасности водных объектов по санитарно-вирусологическим показателям подразумевает концентрирование больших объёмов воды (от 10 до 100 л). Необходимость исследования проб такого объёма требует пересмотра, модернизации и унификации санитарно-вирусологических методов и прежде всего оптимизации процессов концентрирования, режимов и способов пробоподготовки для повышения их эффективности и сокращения времени от момента отбора проб воды до начала её исследования.
Цель – сравнение эффективности сорбции вирусов тремя методами концентрирования: с использованием картриджа с фильтром из стекловолокна, с использованием анионообменной смолы и на проточном мембранном фильтрующем модуле с тангенциально-радиальным движением жидкости с позитивно заряженными микрофильтрационными полиамидными мембранами в режиме микрофильтрации.
Материалы и методы. Тест-вирус – вакцинный вирус полиомиелита Sabin 1 в концентрациях 2; 3 и 4 lg ТЦД50/10 л. Экспериментальные водоёмы готовили на основе дехлорированной водопроводной воды.
Результаты. Все три метода пробоподготовки пригодны для качественного определения вируса полиомиелита в водопроводной воде при концентрации 2 lg ТЦД50/10 л и выше.
Ограничения исследования. Оценка эффективности трёх способов концентрирования вирусов из воды осуществлялась качественным методом. Исследование проводилось с использованием модельных водоёмов, созданных на основе водопроводной воды централизованной водопроводной сети Москвы.
Заключение. Способ концентрирования вирусов с применением метода фильтрации на картриджном фильтре из стекловолокна для пробоподготовки может быть рекомендован при проведении санитарно-вирусологического исследования воды на наличие возбудителей кишечных инфекций вирусной природы наряду с методами концентрирования с использованием анионообменной смолы и на проточном мембранном фильтрующем модуле с тангенциально-радиальным движением жидкости с позитивно заряженными микрофильтрационными полиамидными мембранами в режиме микрофильтрации.
Соблюдение этических стандартов. Исследование не требует предоставления заключения комитета по биомедицинской этике или иных документов.
Участие авторов:
Абрамов И.А. – концепция и дизайн исследования, проведение экспериментов, анализ литературы и экспериментальных данных, визуализация, написание текста, структурирование рукописи, редактирование;
Недачин А.Е., Тымчук С.Н. – концепция и дизайн исследования, проведение экспериментов, редактирование;
Карбовничая К.В. – проведение экспериментов.
Все соавторы – утверждение окончательного варианта статьи, ответственность за целостность всех её частей.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Финансирование. Исследование проведено в рамках договора 01-12/03-24 от 19.03.2024 г. с ЗАО «РОСА».
Поступила: 13.02.2025 / Поступила после доработки: 09.09.2025 / Принята к печати: 02.12.2025 / Опубликована: 15.01.2026
Для цитирования:
Абрамов И.А., Недачин А.Е., Тымчук С.Н., Карбовничая К.В. Сравнительная оценка эффективности сорбции вирусов из воды на картриджном фильтре со стекловолокном и методов концентрирования, рекомендованных нормативными документами. Гигиена и санитария. 2025;104(12):1764-1771. https://doi.org/10.47470/0016-9900-2025-104-12-1764-1771. EDN: hwgtsa
For citation:
Abramov I.A., Nedachin A.E., Tymchuk S.N., Karbovnichaya K.V. Comparative assessment of the efficiency of virus sorption on a cartridge filter from water with fiberglass in comparison with the methods recommended by regulatory documents. Hygiene and Sanitation. 2025;104(12):1764-1771. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1764-1771. EDN: hwgtsa
Введение
Питьевая вода относится к важным стратегическим ресурсам, её качество в значительной степени влияет на здоровье и благополучие населения. Согласно статье 18 Федерального закона «О санитарно-эпидемиологическом благополучии населения» № 52-ФЗ, водные объекты, используемые в целях питьевого и хозяйственно-бытового водоснабжения, а также в лечебных, оздоровительных и рекреационных целях, в том числе водные объекты, расположенные в границах городских и сельских населённых пунктов (далее – водные объекты), не должны быть источниками биологических, химических и физических факторов вредного воздействия на человека. Кроме того, в соответствии со статьёй 19 закона № 52-ФЗ питьевая вода должна быть безопасной в эпидемиологическом и радиационном отношении, безвредной по химическому составу и должна иметь благоприятные органолептические свойства. Использование недоброкачественной воды может приводить к возникновению острых кишечных инфекций бактериальной, паразитарной и вирусной природы. Поэтому постоянный мониторинг эпидемической опасности питьевой воды и других водных объектов является не просто актуальной, но первоочередной задачей государства для обеспечения безопасности населения.
Оценка эпидемической опасности воды как объекта окружающей среды осуществляется в основном косвенно – путём определения санитарных показателей, отражающих степень её фекального загрязнения. Как правило, используются бактериологические показатели ввиду простоты их определения, скорости и информативности, однако с водой могут передаваться и более 150 вирусов, вызывающих различные кишечные инфекции человека и теплокровных животных. По сравнению с бактериями вирус гепатита А, энтеровирусы, аденовирусы и другие простоорганизованные вирусы обладают более высокой устойчивостью к различным методам обеззараживания [1–10], поэтому бактериальные показатели не всегда объективно отражают эффективность и качество подготовки питьевой воды или опасность водного объекта в отношении вирусных инфекций.
Повышенное внимание к контролю воды по вирусологическим показателям отражено в СанПиН 1.2.3685–21, которые в отличие от предыдущих нормативных документов регламентируют определение показателя «возбудители кишечных инфекций вирусной природы» для всех типов вод. Также в документе установлен единый нормируемый объём проб для разных типов вод – 10 л.
Сложность санитарно-вирусологических исследований воды заключается в низких концентрациях содержания вирусных частиц в объектах. Такого количества вирусных частиц достаточно для реализации водного пути передачи вирусной инфекции, но недостаточно для определения существующими вирусологическими методами из-за их низкой чувствительности. Поэтому анализ проб водных объектов по санитарно-вирусологическим показателям подразумевает исследование больших объёмов воды (от 10 до 100 л), для чего во всех методах вирусологического анализа присутствует этап концентрирования пробы [11–15]. Необходимость исследования проб такого объёма требует пересмотра, модернизации и унификации санитарно-вирусологических методов и прежде всего оптимизации процессов концентрирования, режимов и способов пробоподготовки для повышения их эффективности и сокращения времени от момента отбора проб воды до начала её исследования [16].
Многие методические документы по проведению санитарно-вирусологического исследования различных типов вод, действующие на территории Российской Федерации, регламентируют методы концентрирования, которые имеют как преимущества, так и недостатки.
Метод концентрирования вирусов с использованием анионоактивных смол несложен в исполнении, позволяет сконцентрировать нормируемый объём пробы воды, однако концентрирование пробы и обработка элюата требуют значительных временных затрат (до 18 ч), что ограничивает возможность экстренного реагирования на вирусное загрязнение в случае профилактических и противоэпидемических мероприятий.
Метод концентрирования вирусов с использованием фильтрующего мембранного модуля с тангенциально-радиальным движением жидкости с позитивно заряженными микрофильтрационными полиамидными мембранами в режиме микрофильтрации (далее – метод модульной мембранной фильтрации) удобен в реализации, время концентрирования 10 л пробы воды составляет в среднем 1,5–2,5 ч, существуют мобильные версии мембранного модуля для работы в полевых условиях. Главным недостатком метода является чувствительность фильтрационных мембран к засорению взвешенными частицами, что ограничивает использование метода модульной мембранной фильтрации преимущественно для исследования проб питьевых и подземных вод [17].
Существует ещё один метод, который лишён многих недостатков двух предыдущих, но который в настоящее время не входит в методические документы, действующие на территории Российской Федерации. Это метод концентрирования пробы с использованием картриджа с фильтром из стекловолокна (далее – метод картриджной фильтрации), который является адаптированным методом французского стандарта XP T90-451-1996, широко используемого в странах ЕС. Метод картриджной фильтрации зарекомендовал себя как быстрый и относительно простой метод концентрирования энтеровирусов из всех типов вод, позволяющий исследовать большие объёмы воды – от 10 до 100 л [18, 19].
Цель работы – сравнение эффективности сорбции вирусов тремя методами концентрирования: с использованием картриджа с фильтром из стекловолокна, с использованием анионообменной смолы и на проточном мембранном фильтрующем модуле с тангенциально-радиальным движением жидкости с позитивно заряженными микрофильтрационными полиамидными мембранами в режиме микрофильтрации.
Материалы и методы
На основании МУК 4.2.2357–08 «Организация и проведение вирусологических исследований материалов из объектов окружающей среды на полиовирусы, другие (неполио) энтеровирусы» для экспериментальных исследований в качестве тест-вируса выбран вакцинный вирус полиомиелита Sabin 1 в концентрациях 2; 3 и 4 lg ТЦД50/10 л.
Тест-вирус культивировался на культуре клеток HEP-2. Используемые концентрации суспензии вакцинного вируса полиомиелита создавались методом десятикратных разведений в 0,9%-м физиологическом растворе непосредственно перед созданием экспериментальных водоёмов, которые готовили из дехлорированной водопроводной воды с добавлением 200 мг тиосульфата натрия на 10 л воды.
Концентрирование вирусов методом с использованием ионообменных смол и методом модульной мембранной фильтрации проводили в соответствии с МУК 4.2.2029–05 «Санитарно-вирусологический контроль водных объектов».
Концентрирование вирусов методом картриджной фильтрации на фильтре из стекловолокна проводили следующим образом. Для картриджей диаметром 40 мм готовили три навески стекловолокна по 13 г. В эмалированный лоток наливали ~ 1,5 л дистиллированной воды и помещали в него навески, разместив каждую отдельно. Увлажнённые навески стекловолокна по очереди помещали в картридж с открытым нижним краном и запрессовывали с помощью специального устройства, после чего закручивали крышку картриджа. Картридж закрепляли вертикально в штативе, затем при помощи водоструйного насоса последовательно пропускали через фильтр:
- 200 мл раствора 1 М HCl;
- 500 мл дистиллированной воды;
- 200 мл раствора 1 М NaOH;
- 2000 мл дистиллированной воды.
После промывки входной и выходной шланги картриджа соединяли при помощи быстросъёмных разъёмов, укладывали в новый полиэтиленовый пакет и помещали в холодильник.
Концентрирование модельной пробы выполняли с помощью фильтровальной установки, состоящей из насоса, ёмкости для напорного фильтрования объёмом 10 л, стерильного входного шланга для каждого картриджа, самого картриджа с подготовленным фильтром из стекловолокна, краном и выводным шлангом.
Подготовленный картридж доставали из пакета, закрепляли на штативе, размыкали штуцеры быстросъёмных соединений. Стерильный входной шланг одним концом подсоединяли к выходному шлангу ёмкости для напорного фильтрования, а другим концом – к входному шлангу картриджа. Выходной шланг картриджа опускали в горловину ёмкости с концентратом штатного дезинфицирующего средства для сбора и обеззараживания фильтрованной воды из экспериментального водоёма.
Аккуратно залив подготовленную воду экспериментального водоёма в ёмкость для напорного фильтрования, плотно закрывали крышку. Открыв кран на картридже, включали насос и регулировали расход воды на уровне ~ 1 л/мин. После прохождения всего объёма воды выключали насос и закрывали кран на картридже. По окончании фильтрования спускали давление в системе, затем входной шланг аккуратно отсоединяли от выходного шланга ёмкости для напорного фильтрования и от картриджа и помещали в широкогорлую ёмкость с раствором дезинфицирующего средства для обеззараживания.
Не сливая свободную воду из картриджа, его входной шланг подсоединяли к шлангу перистальтического насоса для проведения элюирования: с помощью перистальтического насоса пропускали 300 мл элюента, не допуская осушения стекловолокна и оставляя над поверхностью фильтра столб жидкости ~ 1 см. Элюат собирали в стерильную ёмкость вместимостью 500 мл. Помещали в ёмкость стерильный магнит и устанавливали флакон на магнитную мешалку, добившись равномерного перемешивания раствора, и доводили значение рН элюата до 3,5, измеряя значение с помощью рН-метра и добавляя по каплям раствор 3 М HСl. Затем ёмкость с элюатом помещали на горизонтальный шейкер для равномерного перемешивания в течение 45 мин. По окончании перемешивания извлекали магнит из раствора и делили элюат на 6 центрифужных флаконов по 50 мл для последующего центрифугирования при 3500 g при температуре плюс 4 ± 1 °С в течение 45 мин. После центрифугирования надосадочную жидкость осторожно сливали в отдельный флакон и добавляли туда перекись водорода до конечной концентрации 6% для обеззараживания. Осадок ресуспендировали последовательно от пробирки к пробирке многократным пипетированием в 5 мл раствора 0,15 М Na2НPO4. Ресуспендированный осадок переносили в стерильную центрифужную пробирку и доводили объём концентрата до 10 мл.
Для антибактериальной обработки перед вирусологическим исследованием полученный элюат отбирали в стерильный трёхкомпонентный шприц объёмом 20 мл, после чего элюат продавливали сквозь стерильную насадку с фильтром 0,22 мкм в стерильный флакон.
Для сравнительной оценки эффективности концентрирования вируса полиомиелита на разных системах были выбраны две перевиваемые культуры клеток: HEP-2 и BGM. Выбор культуры клеток HEP-2 обусловлен тем, что суспензия тест-вируса полиомиелита, которая использовалась для заражения, была получена на данной культуре. Выбор культуры клеток BGM обусловлен тем, что данная культура клеток наименее «капризна» при введении чистой культуры, дольше сохраняет свою чувствительность к вирусу полиомиелита, а потому более пригодна к рутинной санитарно-вирусологической практике как одна из двух культур клеток для выделения и дифференциации энтеровирусов из воды.
Качественное определение цитопатического действия (ЦПД) вируса на культурах клеток проводили в соответствии с МУК 4.2.2029–05 «Санитарно-вирусологический контроль водных объектов».
Результаты
Результаты проведённых исследований представлены в табл. 1.
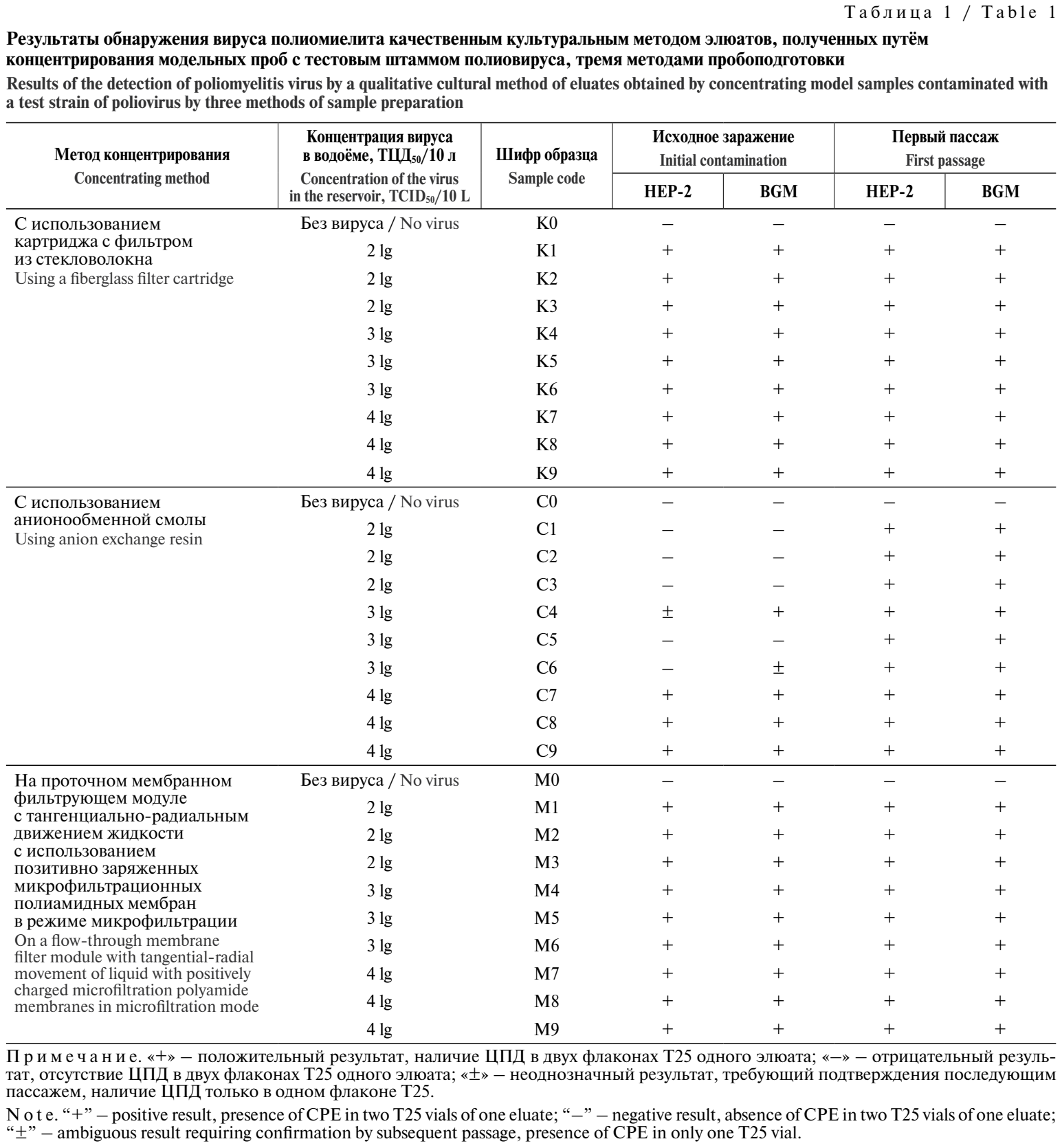
Как видно из таблицы, концентрирование вирусов методом картриджной фильтрации на фильтрах из стекловолокна (К1–К9) и методом модульной мембранной фильтрации на проточном мембранном фильтрующем модуле с тангенциально-радиальным движением жидкости с использованием позитивно заряженных микрофильтрационных полиамидных мембран в режиме микрофильтрации (М1–М9) позволило определить наличие вируса полиомиелита в экспериментальных водоёмах, контаминированных тест-вирусом в наименьшей внесённой концентрации (2 lg ТЦД50/10 л) и выше, уже при исходном заражении на обеих использованных культурах клеток.
Концентрирование вирусов методом с анионоактивными смолами не позволило выделить тестовый вирус полиомиелита из экспериментальных водоёмов, контаминированных дозами в концентрациях 2 и 3 lg ТЦД50/10 л (С1–С6) при первичном заражении. Однако при последующем слепом пассаже материала из «отрицательных» флаконов ЦПД было выявлено, что подтвердило наличие ЦПА (тест-вируса) в исследуемых элюатах. Метод концентрирования на анионообменных смолах позволил обнаружить тестовый вирус только при исходном заражении экспериментального водоёма дозой тест-вируса 4 lg ТЦД50/10 л.
Образцы с шифрами К0, С0, М0 получены из контрольных водоёмов, в которые тестовый штамм вируса не вносили. При исследовании элюатов контрольных проб ЦПА или токсический эффект (ТЭ) обнаружены не были, что свидетельствует об отсутствии в элюатах любых цитопатогенных или цитотоксических агентов как биологической, так и небиологической природы.
С учётом вышеизложенного можно утверждать, что использованные в работе методы концентрирования отличаются по своей эффективности, но все они пригодны для определения наличия вируса полиомиелита в водопроводной воде при уровнях контаминации от 2 lg ТЦД50/10 л и выше.
Обсуждение
Проведённое исследование показало неравнозначную эффективность пробоподготовки для вирусологического анализа при использовании разных методов концентрирования вирусов. Наименьшую эффективность продемонстрировал метод сорбции на анионоактивных смолах. Его чувствительность оказалась на два порядка ниже по сравнению с методами картриджной фильтрации на стекловолокне и модульной мембранной фильтрации, а длительность пробоподготовки составила ~ 18 ч. Тем не менее данный метод продемонстрировал свою пригодность для санитарно-вирусологического анализа воды. Недостаточную эффективность сорбции на анионоактивных смолах компенсирует то, что из-за низких концентраций вирусов в объектах окружающей среды при вирусологическом анализе элюатов проб на перевиваемых культурах клеток обязательно проведение не менее двух слепых пассажей, что повышает чувствительность метода в целом.
Методы концентрирования на картриджах со стекловолокном и фильтрации на проточном мембранном фильтрующем модуле с тангенциально-радиальным движением жидкости с использованием позитивно заряженных микрофильтрационных полиамидных мембран в режиме микрофильтрации показали сходную эффективность, а время их реализации было сравнимо. Тем не менее метод картриджной фильтрации обладает рядом неявных преимуществ. Фильтрация через картридж со стекловолокном позволяет концентрировать до 100 л пробы, в то время как метод модульной мембранной фильтрации – только 10 л, при этом длительность пробоподготовки при использовании картриджной фильтрации возрастёт незначительно, так как основное время занимают элюация и вторичное концентрирование, а не фильтрация. Концепция сменных картриджей упрощает исследование нескольких последовательных проб, так как не требует обеззараживания оборудования между пробами, даёт возможность отбора проб на месте и упрощает доставку проб с места отбора в лабораторию.
Фильтрующие модули с тангенциально-радиальным движением жидкости с позитивно заряженными микрофильтрационными полиамидными мембранами в режиме микрофильтрации также могут использоваться в полевом варианте, но это сопряжено с рядом сложностей и не имеет широкого применения.
Тем не менее следует помнить, что в рутинной практике при исследовании различных типов вод на наличие ПБА вирусной этиологии эффективность пробоподготовки имеет большое, но не единственно важное значение. При выборе способа пробоподготовки следует учитывать весь комплекс критериев, таких как возможности конкретной лаборатории, доступность расходных материалов, наличие оборудования, скорость и экономическая рентабельность используемого метода и др. Критерии выбора методов пробоподготовки представлены в табл. 2.

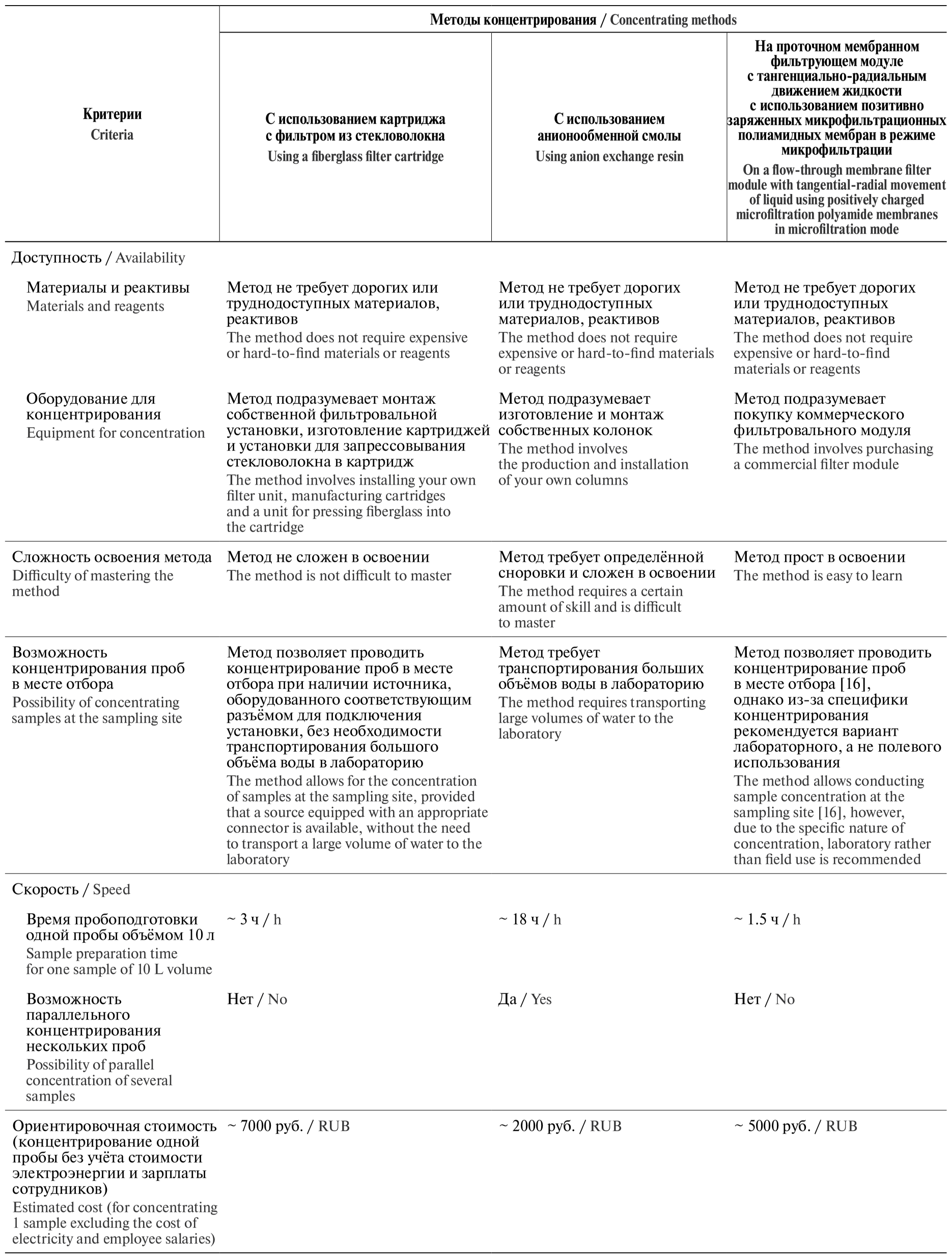
В результате сравнительной оценки эффективности сорбции вирусов тремя методами концентрирования установлено, что эффективность метода концентрирования вирусов с использованием картриджной фильтрации на стекловолокне не уступает методу концентрирования вирусов с применением проточного мембранного фильтрующего модуля с тангенциально-радиальным движением жидкости с позитивно заряженными микрофильтрационными полиамидными мембранами в режиме микрофильтрации и превышает эффективность метода концентрирования вирусов с использованием анионоактивных смол. Все три метода позволяют определять наличие вируса полиомиелита в дехлорированной водопроводной воде в концентрации от 2 lg ТЦД50/10 л и выше, однако метод концентрирования на анионоактивных смолах требует проведения дополнительных слепых пассажей после первичного заражения культур клеток.
Каждый из трёх изученных методов имеет достоинства и недостатки, следовательно, можно подобрать оптимальный метод для конкретных лабораторий и для решения разных задач в рамках санитарно-вирусологического исследования воды.
Ограничения исследования. Исследование эффективности концентрирования трёх методов проводилось качественно, а не количественно, поэтому не было возможности оценить минимальную предельную концентрацию для каждого метода, чтобы ранжировать их по эффективности.
В исследовании использовали модельные водоёмы, созданные на основе водопроводной воды централизованной водопроводной сети Москвы. При концентрировании вируса из воды с другими химическими и органолептическими показателями, влияющими на материалы и реактивы, используемые в методиках, но не превышающими установленные гигиенические нормативы для водопроводной воды, результат может иметь незначительные погрешности.
Заключение
Метод концентрирования вирусов с использованием картриджной фильтрации на фильтре из стекловолокна может быть рекомендован для пробоподготовки при санитарно-вирусологическом исследовании воды на наличие возбудителей кишечных инфекций вирусной природы.
Использование и внедрение в рутинную практику санитарно-микробиологических лабораторий удобных, доступных, быстрых и эффективных методов концентрирования вирусов из различных типов вод позволит улучшить санитарно-эпидемиологический контроль и надзор за ОКИ с водным путём передачи, а также проводить своевременную оценку эпидемической безопасности воды, используемой населением в питьевых и хозяйственно-бытовых целях.
Список литературы
1. Мокиенко А.В., Гоженко А.И., Петренко Н.Ф., Пономаренко А.Н. Вода и водно-обусловленные инфекции. Том I. Одесса: Лерадрук; 2008.
2. Хотько Н.И., Дмитриев А.П. Водный фактор в передаче инфекций. Пенза; 2002.
3. Symonds E.M., Griffin D.W., Breitbart M. Eukaryotic viruses in wastewater samples from the United States. Appl. Environ. Microbiol. 2009; 75(5): 1402–9. https://doi.org/10.1128/AEM.01899-08
4. Carducci A., Morici P., Pizzi F., Battistini R., Rovini E., Verani M. Study of the viral removal efficiency in a urban wastewater treatment plant. Water Sci. Technol. 2008; 58(4): 893–7. https://doi.org/10.2166/wst.2008.437
5. Osuolale O., Okoh A. Human enteric bacteria and viruses in five wastewater treatment plants in the Eastern Cape, South Africa. J. Infect. Public Health. 2017; 10(5): 541–7. https://doi.org/10.1016/j.jiph.2016.11.012
6. Fernández-Molina M.C., Álvarez A., Espigares M. Presence of hepatitis a virus in water and its relationship with indicators of fecal contamination. Water Air Soil. Poll. 2004; 159(1): 197–208. https://doi.org/10.1023/B:WATE.0000049176.30748.0b
7. Lucena F., Finance C., Jofre J., Sancho J., Schwartzbrod L. Viral pollution determination of superficial waters (river water and sea-water) from the urban area of Barcelona (Spain). Water Res. 1982; 16(2): 173–7. https://doi.org/10.1016/0043-1354(82)90107-5
8. Lin J., Singh A. Detection of human enteric viruses in Umgeni River, Durban, South Africa. J. Water Health. 2015; 13(4): 1098–112. https://doi.org/10.2166/wh.2015.238.
9. Sattar S.A., Westwood J.C. Viral pollution of surface waters due to chlorinated primary effluents. Appl. Environ. Microbiol. 1978; 36(3): 427–31. https://doi.org/10.1128/aem.36.3.427-431.1978
10. Дмитриева Р.А., Доскина Т.В., Загайнова А.В., Недачин А.Е., Абрамов И.А., Булатова К.В. Изучение циркуляции вирусов в воде поверхностных водоёмов и в сточных водах. Гигиена и санитария. 2019; 98(11): 1201–5. https://elibrary.ru/pwsnxm
11. Недачин А.Е., Дмитриева Р.А., Лаврова Д.В., Санамян А.Г., Доскина Т.В. Методы концентрирования вирусов из воды при санитарно-микробиологическом контроле. Гигиена и санитария. 2006; 85(2): 81–3. https://elibrary.ru/htanvt
12. Багдасарьян Г.А. Актуальные вопросы санитарной вирусологии некоторых объектов внешней среды: Автореф. дисс. … д-ра мед. наук. М.; 1972.
13. Дмитриева Р.А. Гигиенические вопросы водного пути передачи вирусных гепатитов. Гигиена и санитария. 1988; 67(8): 56.
14. Bosch A., Pinto R.M., Blanch A.R., Jofre J.T. Detection of human rotavirus in sewage through two concentration procedures. Water Res. 1988; 22(3): 343–8. https://doi.org/10.1016/S0043-1354(88)90200-X
15. Gajardo R., Bouchriti N., Pinto R.M., Bosch A. Genotyping of rotaviruses isolated from sewage. Appl. Environ. Microbiol. 1995; 61(9): 3460–2. https://doi.org/10.1128/aem.61.9.3460-3462.1995
16. Загайнова А.В., Юдин С.М., Абрамов И.А., Недачин А.Е., Асланова М.М., Лукашина М.В. и др. Определение перечня потенциально патогенных и патогенных микроорганизмов бактериальной, вирусной и паразитарной природы, циркулирующих в сточных и поверхностных водах. Медицинская паразитология и паразитарные болезни. 2021; (2): 50–63. https://elibrary.ru/bacglw
17. Малышев В.В., Змеева Т.А., Сбойчаков В.Б., Потапова Т.А. Мембранные технологии в полевой микробиологии. Проблемы и решения. В кн.: Микробиология военной медицине и здравоохранению. Современные технологии: наука, практика, инновации: Материалы Всероссийской научно-практической конференции, посвященной 100-летию со дня основания кафедры микробиологии Военно-медицинской академии имени С.М. Кирова. СПб.; 2023: 97–101. https://elibrary.ru/jmllrp
18. Конторович В.Б., Кашкарова Г.П. Вирусологическое обследование различных вод Московского региона. Гигиена и санитария. 2002; 81(2): 65–7.
19. Конторович В.Б. Многолетнее вирусологическое обследование вод Московского региона. В кн.: ЭКВАТЕК – 2002: Материалы конгресса. М.; 2002.
Об авторах
Иван Алексеевич АбрамовРоссия
Мл. науч. сотр. лаб. микробиологии паразитологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: IAAbramov@cspfmba.ru
Александр Евгеньевич Недачин
Россия
Канд. мед. наук, вед. биолог лаб. микробиологии паразитологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
Сергей Николаевич Тымчук
Россия
Канд. мед. наук, начальник отд. биологических методов анализа ЗАО «Роса», 119297, Москва, Россия
Ксения Валентиновна Карбовничая
Россия
Вирусолог 1-й категории отд. биологических методов анализа ЗАО «Роса», 119297, Москва, Россия
Рецензия
Для цитирования:
Абрамов И.А., Недачин А.Е., Тымчук С.Н., Карбовничая К.В. Сравнительная оценка эффективности сорбции вирусов из воды на картриджном фильтре со стекловолокном и методов концентрирования, рекомендованных нормативными документами. Гигиена и санитария. 2025;104(12):1764-1771. https://doi.org/10.47470/0016-9900-2025-104-12-1764-1771. EDN: hwgtsa
For citation:
Abramov I.A., Nedachin A.E., Tymchuk S.N., Karbovnichaya K.V. Comparative assessment of the efficiency of virus sorption on a cartridge filter from water with fiberglass in comparison with the methods recommended by regulatory documents. Hygiene and Sanitation. 2025;104(12):1764-1771. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1764-1771. EDN: hwgtsa
JATS XML









































