Перейти к:
Иммунный и генетический статус детей, проживающих в условиях аэрогенной экспозиции никелем
https://doi.org/10.47470/0016-9900-2025-104-12-1721-1726
EDN: ptnnbg
Аннотация
Введение. Оценка воздействия на детский организм химических факторов, ассоциированных с особенностями точечных однонуклеотидных замен в генах детоксикации, – актуальная гигиеническая задача.
Материалы и методы. Обследованы дети группы наблюдения (n = 44), проживающие в условиях аэрогенной экспозиции никелем (1,28 ПДКс.г.) и дети группы сравнения (n = 45), проживающие на условно чистой территории (менее 0,1 ПДКс.г.). В работе использованы методы: масс-спектрометрия, иммуноферментный, аллергосорбентный, проточной цитометрии и ПЦР РВ.
Результаты. Ингаляционная экспозиция никелем (до 1,28 ПДКс.г.) при поступлении его в дозе 0,00207 мг/кг в день обусловливает повышение уровня контаминации крови детей группы наблюдения относительно группы сравнения в 1,73 раза. У детей группы наблюдения установлено статистически значимое (р < 0,05) повышение количества CD4+CD25+CD127–-регуляторных клеток (в 1,5 раза), концентрации кортизола (в 1,7 раза), уровня специфических IgE-антител к никелю (1,3 раза) и увеличение числа CD4+-лимфоцитов (на 10%) относительно значений у детей группы сравнения. Выявлен полиморфизм генов, контролирующих процессы детоксикации и апоптоза, – CYP1A1, GSTP1, TP53 и CPOX (RR = 1,39–1,96) (RR = 1,96, 95% CI 1,79–2,12; RR = 1,61, 95% CI 1,31–1,97; RR = 1,39, 95% CI 1,05–2,02 и RR = 1,76, 95% CI 1,53–2,01 соответственно). По результатам моделирования в системе «маркёр экспозиции – маркёр эффекта» установлена зависимость, отражающая гиперпродукцию IgЕ, специфического к никелю, IgЕ общего и кортизола в присутствии никеля в крови (RR = 2,42, 95% CI = 1,37–4,27; RR = 2,39, 95% CI = 1,54–3,79; RR = 4,60, 95% CI = 1,05–20,11 соответственно).
Ограничения исследования. Ограничения исследования связаны c относительно небольшим объёмом выборки и несбалансированностью групп детей по половому признаку, что требует проведения дополнительных исследований для верификации полученных результатов.
Заключение. У детей в условиях аэрогенной экспозиции никелем (1,28 ПДКс.г.) и полиморфизма кандидатных генов апоптоза и детоксикации (CYP1A1, GSTP1, TP53, CPOX) формируется риск (RR = 1,39–1,96) избыточной биоэкспозиции никелем (в 2,6 раза), отражающийся на особенностях иммунорегуляции (супрессивная и хелперная активность клеточных кластеров, гиперсенсибилизация к никелю – IgЕ) и адаптации (гиперкортизолемия), что позволяет рекомендовать верифицированные показатели как маркёры эффекта и чувствительности для снижения риска развития аллергических состояний у детей, проживающих в регионах с негативными изменениями среды обитания (на примере соединений никеля).
Соблюдение этических стандартов. Протокол исследования одобрен комитетом по биомедицинской этике «Локальный этический комитет ФБУН «ФНЦ МПТ УРЗН» (протокол № 7 от 19.12.2022 г.). Все участники и их законные представители дали информированное добровольное письменное согласие на участие в исследовании.
Участие авторов:
Дианова Д.Г. – концепция и дизайн исследования, написание текста;
Долгих О.В. – концепция исследования, анализ и интерпретация данных, редактирование;
Казакова О.А., Ширинкина А.С. – сбор и обработка данных, составление таблиц.
Все соавторы – утверждение окончательного варианта статьи и ответственность за целостность всех её частей.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Финансирование. Исследование не имело спонсорской поддержки.
Поступила: 24.09.2025 / Принята к печати: 02.12.2025 / Опубликована: 15.01.2026
Ключевые слова
Для цитирования:
Дианова Д.Г., Долгих О.В., Казакова О.А., Ширинкина А.С. Иммунный и генетический статус детей, проживающих в условиях аэрогенной экспозиции никелем. Гигиена и санитария. 2025;104(12):1721-1726. https://doi.org/10.47470/0016-9900-2025-104-12-1721-1726. EDN: ptnnbg
For citation:
Dianova D.G., Dolgih O.V., Kazakova O.A., Shirinkina A.S. Immune and genetic status in children residing in conditions of airogenic exposure to nickel. Hygiene and Sanitation. 2025;104(12):1721-1726. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1721-1726. EDN: ptnnbg
Введение
Дети, проживающие в зонах воздействия объектов металлургического комплекса и энергетической отрасли, испытывают негативное влияние выбросов, в том числе содержащих никель. У этих детей возрастает риск развития болезней, в патогенезе которых важным звеном является хроническое аллергическое воспаление в тканях и, возможно, реализация IgE-обусловленной сенсибилизации к низкомолекулярным химическим соединениям (НМХС). Манифестация сенсибилизации к никелю предполагает в последующем возникновение рецидива аллергических реакций даже при незначительном (следовом) поступлении этого вещества в организм. В зависимости от частоты и времени воздействия никеля интенсивность аллергического процесса может значительно варьировать. К сожалению, полного купирования гиперчувствительности к никелю практически не происходит [1].
Установлено, что воздействие никеля является причиной никель-ассоциированных аллергических патологий [1, 2]. Имеются данные, подтверждающие гемато-, иммуно-, нейро-, цито-, гено-, нефро- и гепатотоксические свойства никеля [3, 4], доказано его влияние на эндокринную систему. Так, в системе in vivo показано, что никель может увеличивать массу надпочечников, изменять механизмы регуляции гипоталамо-гипофизарно-надпочечниковой оси и нарушать секрецию гормонов [5]. Установлено влияние никеля на регуляцию электролитного состава крови, уровень стресса и физическую активность. Результаты исследований показали, что в условиях хронической гиперкортизолемии формируется дисбаланс между звеньями клеточного и гуморального иммунитета, нарушаются врождённые и адаптивные иммунные реакции, возникает перенапряжение регуляторных механизмов [5]. Устойчивость организма к НМХС обеспечивает система детоксикации. Дисбаланс в системе обезвреживания ксенобиотиков формируется за счёт генетического полиморфизма генов ферментов 1-й и 2-й фаз детоксикации, что является одним из факторов риска аллергической гиперчувствительности [6].
Очевидно, никель, поступающий в окружающую среду в результате производственной деятельности, повышает риск развития нарушений здоровья и в первую очередь аллергии, причём дети в силу возрастной морфофункциональной незрелости иммунной системы, а также особенностей гормонального статуса и детоксикационной способности наиболее чувствительны к средовым химическим факторам с аллергенным потенциалом.
Цель работы – изучить особенности иммунного и генетического статуса детей, проживающих в условиях аэрогенной экспозиции никелем.
Материалы и методы
Для научного обоснования показателей, отражающих особенности адаптационных возможностей детского организма в условиях биоэкспозиции никелем, выполнены медико-биологические исследования, соответствующие стандартам комитета по биомедицинской этике ФБУН «ФНЦ МПТ УРЗН» и требованиям Хельсинкской декларации Всемирной медицинской ассоциации 2000 г. (ред. 2013 г.). На территории наблюдения размещены предприятия металлургического комплекса и энергетики, отмечено превышение среднегодовой концентрации (ПДКс.г.) никеля до 1,28 ПДКс.г. Среднегодовые концентрации никеля в атмосферном воздухе на условно чистой территории не превышали гигиенических нормативов (0,00005 мг/м³) [7]. Выполнен расчёт суточной дозы поступления никеля в организм при хронической аэрогенной экспозиции согласно P 2.1.10.3968–23.
В исследовании приняли участие практически здоровые дети дошкольного возраста (n = 89), посещающие детские дошкольные учреждения и проживающие на территориях с различным содержанием никеля в атмосферном воздухе. Группа наблюдения – дети, проживающие на территории с превышением гигиенического норматива среднегодовой концентрации никеля: n = 44 [мальчики – 12 (27,3%), девочки – 32 (72,7%)]. Группа сравнения – дети, проживающие вне зоны загрязнения атмосферного воздуха никелем: n = 45 [мальчики – 23 (51,1%), девочки – 22 (48,9%)]. Критерии включения в исследование: возраст от 4 до 6 лет; отсутствие указаний о приёме лекарственных препаратов, обладающих иммунотропным действием, в последние 6 мес. Критерии исключения: на момент обследования диагностированы острые инфекционные болезни; участие в другом исследовании. Все участники и их законные представители дали информированное добровольное письменное согласие на участие в исследовании, ознакомились с протоколом.
Химический анализ крови для количественного определения никеля выполнен методом масс-спектрометрии с индуктивно связанной плазмой в соответствии с МУК 4.1.3230–14 на приборе Agilent 7500сх (СШA). Исследование специфических IgЕ-антител к никелю проведено посредством аллергосорбентного тестирования с ферментной меткой, IgE общего и кортизола – методом иммуноферментного анализа на анализаторе ELx808IU (BioTek, СШA), IgG – методом однократной радиальной иммунодиффузии по Манчини. Методом проточной цитометрии выполнена количественная оценка уровня CD3+CD4+, CD4+CD25+CD127+ (Treg) (Becton Dickinson, СШA).
Для анализа частоты распределения полиморфных маркёров (аллелей, генотипов) в генах CPOX A/C (rs1131857), CYP1A1 Ile462Val (rs1048943), GSTP1 Ile105Val (rs1695), TP53 Arg72Pro (rs1042522) использован метод полимеразной цепной реакции (ПЦР) в режиме реального времени с последующим анализом кривых плавления продуктов амплификации на приборе BioRAD CFX96 (Singapore). Сравнение частот встречаемости генотипов для выявления ассоциации с риском развития сенсибилизации выполняли с использованием критерия χ², тест на соответствие распределения генотипов равновесию Харди – Вайнберга проводили с использованием точного критерия (HWE-критерий), для описания полиморфизмов генов использованы N-число, процент; для аллель- и генотип-ассоциированных моделей – отношение шансов (OR) и 95%-й доверительный интервал (95% CI). Увеличение вероятности развития нарушений, ассоциированных с областью ответственности гена в организме, при наличии дикой или вариантной (мутантной) аллели оценивалось с использованием критерия RR (относительный риск) и 95%-го доверительного интервала (95% CI). Анализ данных генетических исследований проводился с помощью программы «ГенЭксперт». Статистический анализ данных проведён с помощью пакета Statistica 6.0 (StatSoft, СШA). Тип распределения данных в сформированных выборках определяли по критерию Колмогорова – Смирнова. Данные с нормальным распределением представлены в виде среднего арифметического значения (М) и стандартной ошибки среднего (m). Для оценки статистически значимых различий изучаемых выборок использовали двухвыборочный критерий Стьюдента. Проверка нулевых гипотез об отсутствии различий между выборочными данными и референтными значениями выполнена с помощью Т-критерия Вилкоксона. Значимость различий между долями оценивали по критерию χ². Номинальные переменные представлены в виде относительных частот (%). Выполнен расчёт относительного риска (RR) и 95%-го доверительного интервала для RR (95% CI). Для прогнозирования вероятности нарушения механизмов иммунорегуляции использовали простой логистический регрессионный анализ. Статистически значимыми считались различия, удовлетворявшие требованию p < 0,05.
Результаты
По результатам проведённых исследований установлено, что на территории наблюдения суточная доза никеля, рассчитанная по среднегодовым показателям, составила 0,00207 мг/кг в день, на территории сравнения – 0,000191 мг/кг в день. Результаты оценки содержания никеля в крови всех детей продемонстрировали статистически значимое (р = 0,043) превышение в 1,73 раза уровня никеля в биосредах детей группы наблюдения относительно значений, обнаруженных у обследуемых группы сравнения, и в 2,56 раза – верхней границы фонового уровня (р < 0,05) (табл. 1). Обнаружено, что максимальное содержание никеля в крови детей, проживающих на территории, где среднегодовые концентрации никеля превышали гигиенические нормативы, составило 0,0068 мкг/дм³, а у детей, проживающих на условно чистой территории, – 0,00187 мкг/дм³.
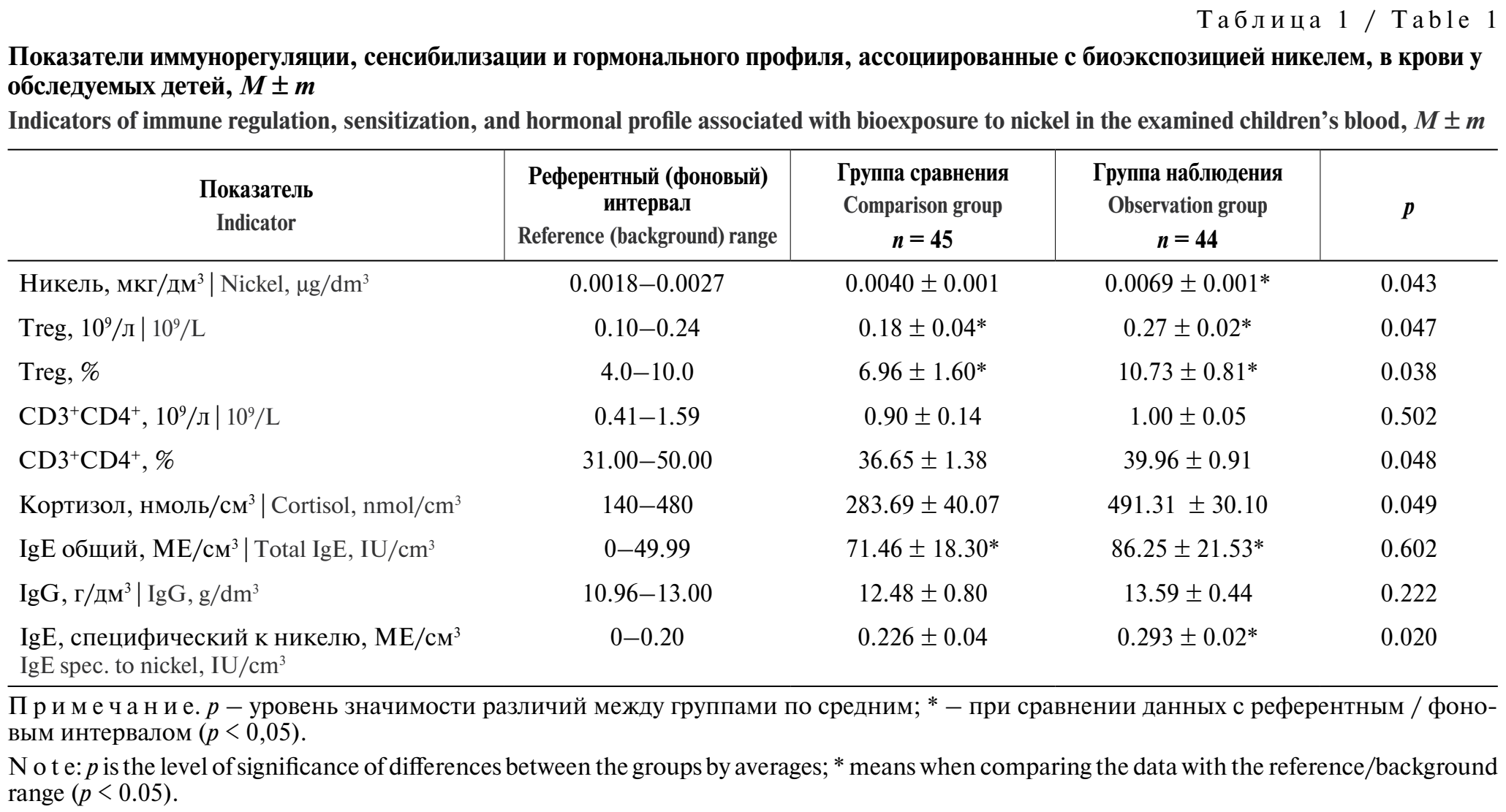
Результаты сравнительной оценки показателей иммунограммы у детей группы наблюдения продемонстрировали статистически значимое (р = 0,038–0,048) увеличение процентного и абсолютного содержания CD4+CD25+CD127+-лимфоцитов, регулирующих силу и продолжительность иммунного ответа, на 50% и повышение числа CD3+CD4+-лимфоцитов, важнейших клеток адаптивного ответа, обеспечивающих координацию иммунного реагирования, на 10% относительно значений группы сравнения. У детей с повышенным уровнем контаминации крови никелем среднегрупповое значение количества Treg выходит за верхнюю границу референтного диапазона. Обнаружено, что у детей, проживающих в условиях экспозиции никелем, среднегрупповое содержание стресс-гормона (кортизола) статистически значимо (р = 0,049) в 1,7 раза выше аналогичного показателя у детей, проживающих на условно чистой территории. Сопоставление результатов специфической сенсибилизации продемонстрировало, что у детей группы наблюдения достоверно на 30% превышена концентрация антител класса Е к никелю по сравнению с результатами, полученными у детей группы сравнения, и на 50% относительно верхней границы референтного диапазона (р < 0,05). Концентрация антител класса G в обеих группах определена в пределах регистровых значений, одновременно наблюдается превышение среднегруппового уровня IgE общего по отношению к верхней границе референтного интервала (р < 0,05).
Выявлено, что у детей с избыточным содержанием никеля в крови доля проб с превышениями референтных значений IgЕ, специфического к никелю, IgЕ общего, IgG и кортизола в 2,4; 2,7; 4,3 и 4,6 раза соответственно выше показателей в группе сравнения (р < 0,05) (табл. 2).
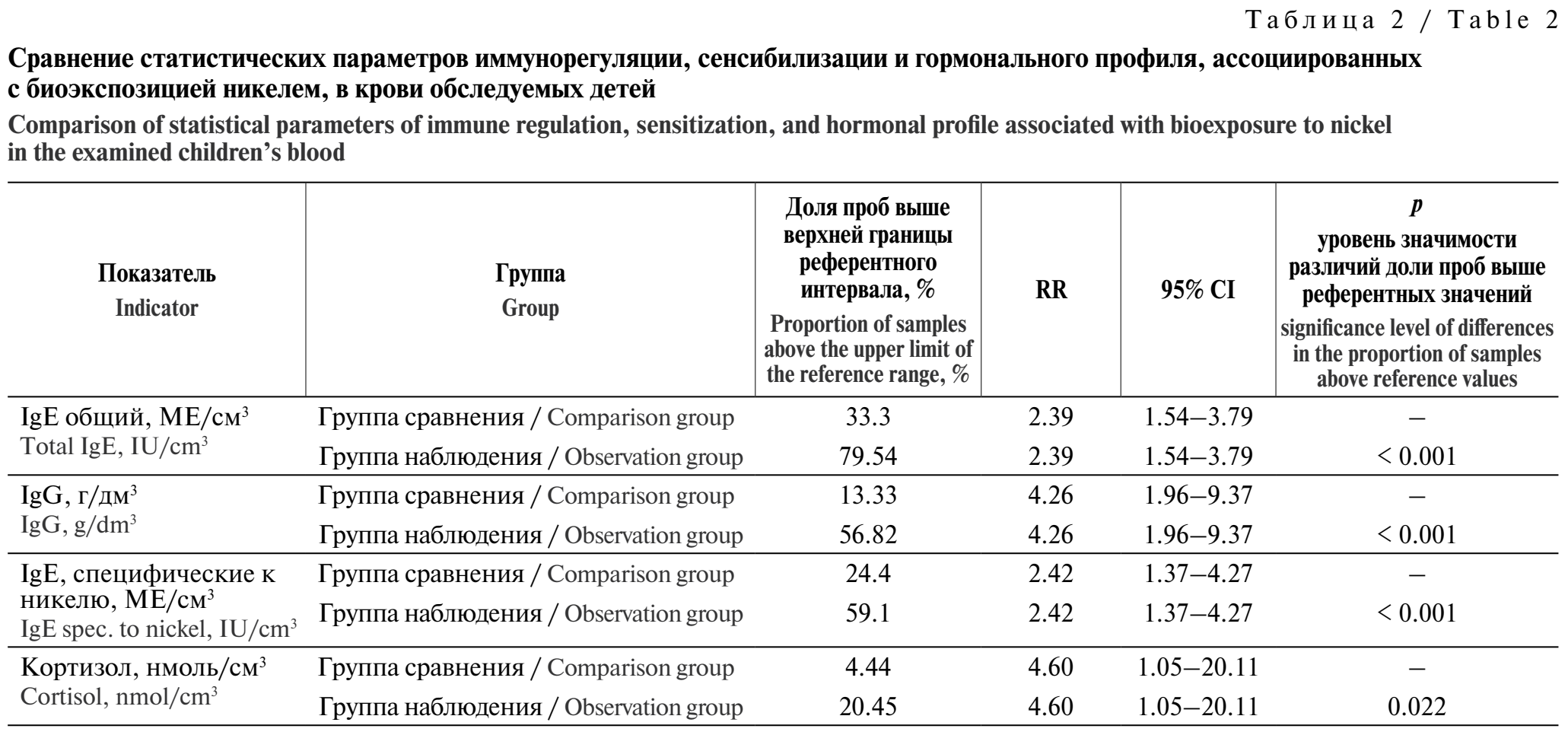
Установлена вероятностная причинно-следственная связь между содержанием никеля в крови и повышением абсолютного числа CD3+CD4+-лимфоцитов и титра IgG (b0 = –3,09, b1 = 137,29, R² = 0,10, F = 11,42, р = 0,002 и b0 = –3,01, b1 = 181,39, R² = 0,3, F = 43,16, р < 0,001 соответственно). Показано, что у обследуемых детей группы наблюдения в условиях повышенного содержания никеля в крови в 2,4–4,6 раза увеличивается относительный риск продукции IgЕ, специфического к никелю, IgЕ общего, IgG и кортизола (RR = 2,42; RR = 2,39; RR = 4,26 и RR = 4,6 соответственно), что позволяет отнести биоэкспозицию никелем к факторам дополнительной сенсибилизации и дезадаптации иммунной системы.
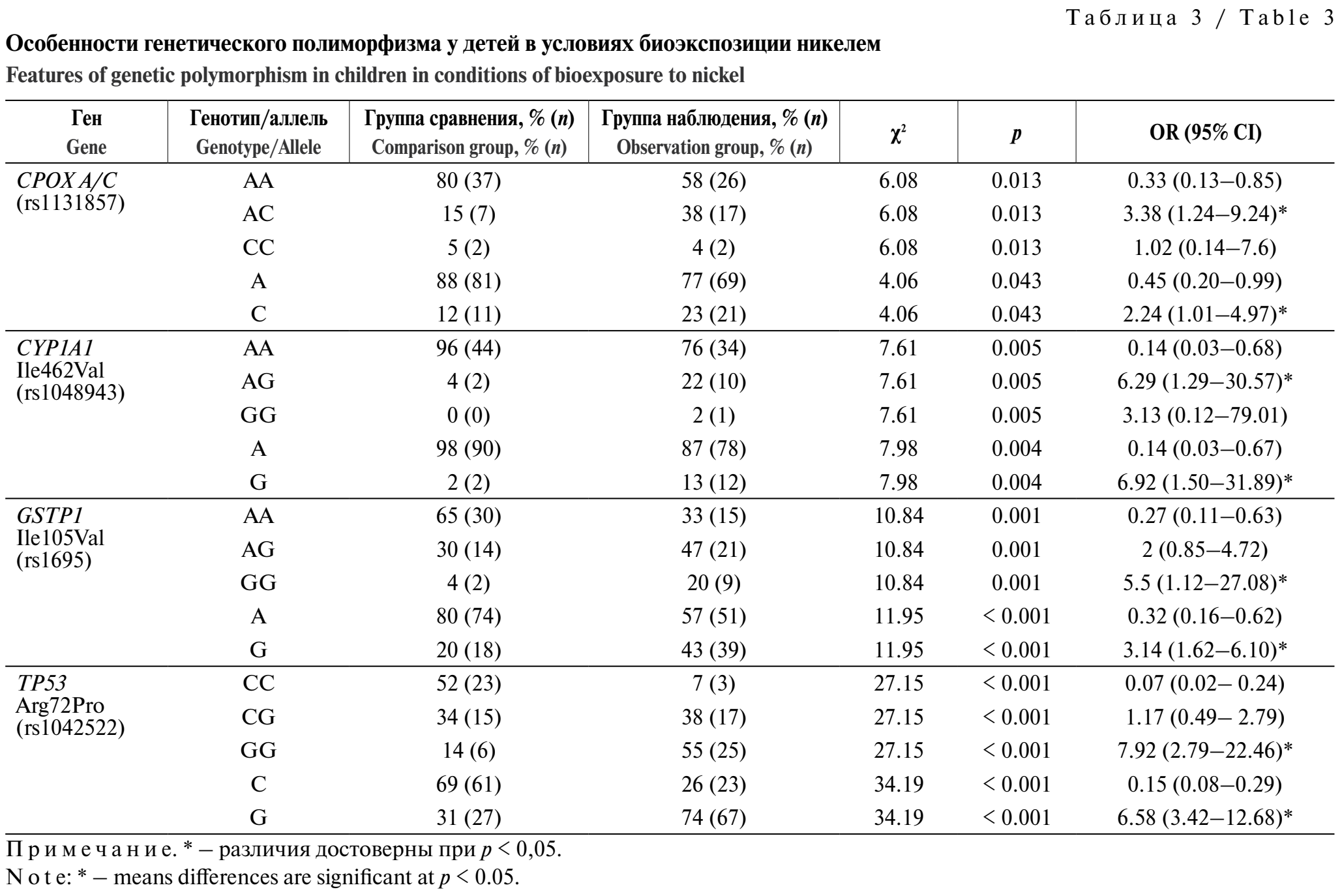
Группа наблюдения характеризуется достоверным повышением: частоты вариантной аллели С (OR = 2,24; 95% CI 1,01–4,97; RR = 1,76, 95% CI 1,53–2,01; p < 0,05) и гетерозиготного генотипа AC (OR = 3,38; 95% CI 1,24–9,24; p < 0,05) гена копропорфириногеноксидазы CPOX A/C rs1131857 в 2 и 2,5 раза соответственно; частоты вариантной аллели G (OR = 6,92; 95% CI 1,5–31,89; RR = 1,96; 95% CI 1,79–2,12; p < 0,05) и гетерозиготного генотипа AG (OR = 6,29; 95% CI 1,29–30,57; p < 0,05) гена первой фазы детоксикации цитохрома Р450 CYP1A1 Ile462Val в 6,1 и 5,1 раза соответственно; частоты вариантной аллели G (OR = 3,14; 95% CI 1,62–6,1; RR = 1,61; 95% CI 1,31–1,97; p < 0,05) и гомозиготного генотипа GG (OR = 5,5; 95% CI 1,12–27,08; p < 0,05) гена второй фазы детоксикации гутатионтрансферазы GSTP1 Ile105Val в 2,2 и 4,6 раза соответственно; частоты вариантной аллели G (OR = 6,58; 95% CI 3,42–12,68; RR = 1,39; 95% CI 1,05–2,02; p < 0,05) и гомозиготного генотипа GG (OR = 7,92; 95% CI 2,79–22,46; p < 0,05) гена онкосупрессора транскрипционного фактора TP53 Arg72Pro в 2,4 и 4,1 раза соответственно, что увеличивает вероятность наступления нежелательных сценариев, ассоциированных с компетентностью кандидатных генов, в 1,4–2 раза (табл. 3).
Обсуждение
Сочетание генетических полиморфизмов кандидатных генов и особенностей компартментов иммунной системы во многом определяет ответ детского организма на воздействие факторов риска, в том числе соединений никеля [8, 9]. Необходимо учитывать незрелость и критические периоды формирования иммунной системы у детей, а также возраст-ассоциированные особенности гормонального фона [8, 10]. Никель – один из триггеров развития и обострения аллергии. Связываясь в крови с альбумином или никельсодержащим белком никелоплазмином, он формирует инверсию иммунного ответа [11]. Кортизол выполняет ключевую роль в регуляции практически всех физиологических процессов в организме [10]. Образование гормон-рецепторного комплекса обусловливает транскрипцию различных генов или трансрепрессию факторов транскрипции, регулирующих гомеостаз, активность лимфоцитов, клеточное деление, апоптоз и др. [12]. Некоторые исследователи говорят о прямой связи между повышенной концентрацией кортизола и тяжестью аллергического процесса [13], однако другие учёные не установили корреляционной связи «кортизол – интенсивность аллергической реакции» [14]. Показано, что глюкокортикоиды в низких дозах оказывают иммуностимулирующий эффект, в высоких – иммунодепрессивное действие. Кортизол, будучи первичным мессенджером, инициирует ответную реакцию иммунокомпетентной клетки. Полагают, что в условиях длительного перепроизводства кортизола у Treg может снижаться иммуносупрессивный потенциал [15–17]. Продолжительная гиперкортизолемия является значимым фактором иммунной дисрегуляции, повышая риск развития иммуноопосредованных патологий в дальнейшем [18, 19]. Результаты настоящего исследования позволяют полагать, что повышение кортизола в крови является маркёром напряжённости адаптивного иммунного ответа в условиях избыточной биоэкспозиции никелем.
Доказана способность регуляторных клеток Treg либо формировать иммунологическую толерантность организма, либо обусловливать обострение болезни при воздействии проаллергических факторов (гаптенов) на фоне развития воспалительного процесса [19, 20]. При аллергии Treg не только демонстрируют количественные и качественные изменения, но и проявляют высокую пластичность. Обнаружено, что численность Treg зависит от присутствия аллергена в организме [21, 22]. Имеются сведения об увеличении у пациентов с аллергопатологией количества Treg и корреляции их содержания с тяжестью болезни [18, 23]. Рекрутирование регуляторных Т-клеток при сенсибилизации организма изучена недостаточно. Результаты настоящего исследования в значительной степени согласуются с данными литературы о наличии у Treg, обладающих фенотипической гетерогенностью и пластичностью, иммунорегуляторной активности, позволяя предполагать, что повышение численности данной популяции клеток является адаптационным процессом при экспозиции никелем.
Аэрогенное воздействие никеля реализует реагиновый тип повреждения тканей, а содержание специфического к никелю IgE характеризует уровень ингаляционной экспозиции и биоэкспозиции никелем [24]. Следует отметить у детей более высокий риск развития сенсибилизации, детерминированный особенностями возрастной функциональной активности иммунной системы [8]. Обнаружено, что у детей с аллергопатологией титр антител к иммуноглобулину E превышает значения у взрослых, при этом уровень аллерген-специфического IgE ассоциирован с тяжестью аллергического процесса и особенностями чувствительности к конкретному аллергену [8]. Результаты исследований и выводы, представленные в настоящей работе, корреспондируются с опубликованными в научной литературе данными, демонстрирующими напряжённость специфического гуморального иммунного ответа у детей в условиях экспозиции НМХС. Таким образом, подтверждается гиперпродукция специфических иммуноглобулинов при избытке никеля в биосредах.
Вариативность иммунного ответа человека обусловлена наследственными факторами и факторами окружающей среды [21]. Продемонстрировано, что однонуклеотидные полиморфизмы генов детоксикации 1-й фазы (цитохрома р 450) и 2-й фазы глутатион-S-трансфераз (GSTP1, GSTM1, GSTT1), гена копропорфириногеноксидазы (CPOX) в результате нокаута их функциональных генотипов теряют способность контролировать метаболизм и элиминацию металлов в организме, в результате чего экзогенные химические факторы среды обитания (соединения никеля) получают возможность негативно реализовать свой токсический потенциал (аллергия, канцерогенез) [25, 26]. Результаты настоящего исследования, которые описывают полиморфизмы генов детоксикации и апоптоза (CYP1A1, GSTP1, TP53, CPOX), ассоциированные с биоэкспозицией никелем, согласуются с данными, полученными другими авторами.
Заключение
Таким образом, сочетание избыточной экспозиции химическими факторами среды обитания (на примере аэрогенной экспозиции никелем) и генетических особенностей в виде точечных дефектов ДНК (на примере SNP генов детоксикации 1-й и 2-й фаз) приводит к стрессовым реакциям и неспособности организма к поддержанию баланса между иммунологической толерантностью и иммунной аутоагрессией, что особенно выражено у детей из-за возрастной наивности иммуноцитов.
В результате проведённых исследований установлено, что условия аэрогенной экспозиции никелем (1,28 ПДКс.г.) и полиморфизма кандидатных генов детоксикации и апоптоза (CYP1A1, GSTP1, TP53, CPOX) приводят к риску (RR = 1,39–1,96) формирования избыточной биоэкспозиции никелем (в 2,6 раза), напряжённости компартментов иммунного статуса (повышение численности субпопуляциии Т-лимфоцитов с супрессивной и хелперной активностью, гиперпродукция IgЕ, специфического к никелю, до 4,3 раза, p < 0,05) и адаптационных процессов (избыток кортизола в 4,6 раза; p < 0,05) [27]. Выявленные отличия от группы сравнения соответствуют аллергическому фенотипу и позволяют рекомендовать верифицированные показатели в качестве маркёров эффекта и чувствительности для задач профилактики развития аллергопатологии у детей, проживающих в условиях дестабилизации среды обитания (на примере соединений никеля).
Список литературы
1. Gates A., Jakubowski J.A., Regina A.C. Nickel Toxicology. Treasure Island (FL): StatPearls Publishing; 2023
2. Bernstein J., Keller L., Pacheco K. Updates in metal allergy: a review of new pathways of sensitization, exposure, and treatment. Curr. Allergy Asthma Rep. 2025; 25(1): 28. https://doi.org/10.1007/s11882-025-01209-6
3. Kang Y.T., Yang W.J., Huang H.C., Tang S.C., Ko J.L. Exposure to nickel chloride induces epigenetic modification on detoxification enzyme glutathione S-transferase M2. Environ. Toxicol. 2024; 39(3): 1729–36. https://doi.org/10.1002/tox.24055
4. Zhou X., Liao J., Lei Z., Yao H., Zhao L., Yang C., et al. Nickel-based nanomaterials: a comprehensive analysis of risk assessment, toxicity mechanisms, and future strategies for health risk prevention. J. Nanobiotechnology. 2025; 23(1): 211. https://doi.org/10.1186/s12951-025-03248-7
5. Balakin E., Yurku K., Ivanov M., Izotov A., Nakhod V., Pustovoyt V. Regulation of stress-induced immunosuppression in the context of neuroendocrine, cytokine, and cellular processes. Biology. 2025; 14(1): 76. https://doi.org/10.3390/biology14010076
6. Бойцова Д.А. Роль генов I фазы детоксикации и недостаточности витамина D в реализации пищевой аллергии у детей. Российский педиатрический журнал. 2024; 27(2S): 15. https://elibrary.ru/zxxsoq
7. Государственный доклад «О состоянии и охране окружающей среды в Красноярском крае в 2022 году». Красноярск; 2023.
8. Yang X., Li S., Chen A., Wang H., Deng S., Ni B., et al. Distinct IgE sensitization profiles in chronic urticaria: a comparative study with classic allergic diseases. Front. Immunol. 2024; 15: 1458839. https://doi.org/10.3389/fimmu.2024.1458839
9. Xu J., Wang B., Ao H. Corticosterone effects induced by stress and immunity and inflammation: mechanisms of communication. Front. Endocrinol. (Lausanne). 2025; 16: 1448750. https://doi.org/10.3389/fendo.2025.1448750.0
10. Nystad K., Drugli M.B., Lydersen S., Tveit H., Lekhal R., Buøen E.S. Тoddlers’ cortisol levels in childcare and at home. Early Educ. Dev. 2025; 36(1): 62–79. https://doi.org/10.1080/10409289.2024.2360873
11. Riedel F., Aparicio-Soto M., Curato C., Thierse H.J., Siewert K., Luch A. Immunological mechanisms of metal allergies and the nickel-specific TCR-pMHC interface. Int. J. Environ. Res. Public Health. 2021; 18(20): 10867. https://doi.org/10.3390/ijerph182010867
12. Todorova M., Todorova K. Changes in cortisol secretion and the role of the glucocorticoid receptor in the development of the immune response in patients with SARS-CoV-2 infection. JBCR. 2025; 18(1): 11–21. https://doi.org/10.3897/jbcr.e135548
13. Vinnik T., Kreinin A., Abildinova G., Batpenova G., Kirby M., Pinhasov A. Biological sex and IgE sensitization influence severity of depression and cortisol levels in atopic dermatitis. Dermatology. 2020; 236: 336–44. https://doi.org/10.1159/000504388
14. Kojima R., Matsuda A., Nomura I., Matsubara O., Nonoyama S., Ohya Y., et al. Salivary cortisol response to stress in young children with atopic dermatitis. Pediatr. Dermatol. 2013; 30(1): 17–22. https://doi.org/10.1111/j.1525-1470.2012.01770.x
15. Gao X., Tang Y., Kong L., Fan Y., Wang C., Wang R. Treg cell: Critical role of regulatory T-cells in depression. Pharmacol. Res. 2023; 195: 106893. https://doi.org/10.1016/j.phrs.2023.106893
16. Abbas A.K., Trotta E., Simeonov D.R., Marson A., Bluestone J.A. Revisiting IL-2: Biology and therapeutic prospects. Sci. Immunol. 2018; 3(25): eaat1482. https://doi.org/10.1126/sciimmunol.aat1482
17. Luo J., Zhou C., Wang S., Tao S., Liao Y., Shi Z., et al. Cortisol synergizing with endoplasmic reticulum stress induces regulatory T-cell dysfunction. Immunology. 2023; 170(3): 334–43. https://doi.org/10.1111/imm.13669
18. Khedri M., Samei A., Fasihi-Ramandi M., Taheri R.A. The immunopathobiology of T cells in stress condition: a review. Cell Stress Chaperones. 2020; 25(5): 743–52. https://doi.org/10.1007/s12192-020-01105-0
19. Conrad M.L., Barrientos G., Cai X., Mukherjee S., Das M., Stephen-Victor E., et al. Regulatory T cells and their role in allergic disease. Allergy. 2025; 80(1): 77–93. https://doi.org/10.1111/all.16326
20. Zhang Z., Guo J., Jia R. Treg plasticity and human diseases. Inflamm. Res. 2023; 72(12): 2181–97. https://doi.org/10.1007/s00011-023-01808-x
21. Lamikanra A.A., Tsang H.P., Elsiddig S., Spencer M., Curnow E., Danby R., et al. The migratory properties and numbers of T regulatory cell subsets in circulation are differentially influenced by season and are associated with vitamin D status. Front. Immunol. 2020; 11: 685. https://doi.org/10.3389/fimmu.2020.00685
22. Nedoszytko B., Lange M., Sokołowska-Wojdyło M., Renke J., Trzonkowski P., Sobjanek M., et al. The role of regulatory T cells and genes involved in their differentiation in pathogenesis of selected inflammatory and neoplastic skin diseases. Part II: The Treg role in skin diseases pathogenesis. Postepy Dermatol. Alergol. 2017; 34(5): 405–17. https://doi.org/10.5114/ada.2017.71105
23. Looman K.I.M., van Meel E.R., Grosserichter-Wagener C., Vissers F.J.M., Klingenberg J.H., de Jong N.W., et al. Associations of Th2, Th17, Treg cells, and IgA+ memory B cells with atopic disease in children: The Generation R Study. Allergy. 2020; 75(1): 178–87. https://doi.org/10.1111/all.14010
24. Зайцева Н.В., Долгих О.В., Дианова Д.Г. Аэрогенная экспозиция никелем и фенолом и особенности иммунного ответа, опосредованного иммуноглобулинами класса Е и G. Анализ риска здоровью. 2023; (2): 160–7. https://doi.org/10.21668/health.risk/2023.2.16 https://elibrary.ru/jcqrud
25. Ширинкина А.С., Долгих О.В. Особенности иммунологических индикаторных показателей у детей с аллергией, модифицированной контаминацией биосред никелем и полиморфизмом гена детоксикации CPOX rs1131857. Здравоохранение Российской Федерации. 2023; 67(6): 519–25. https://doi.org/10.47470/0044-197X-2023-67-6-519-525 https://elibrary.ru/zonxxj
26. Ramírez V., Salcedo-Bellido I., Rodrigo L., Gil Hernández F., Olmedo P., Martínez-González L.J., et al. Association of genetic polymorphisms in detoxifying systems and urinary metal(loid) levels with excess body weight among Spanish children: A proof-of-concept study. Sci. Total. Environ. 2023; 873: 162333. https://doi.org/10.1016/j.scitotenv.2023.162333
27. Xu J., Wang B., Ao H. Corticosterone effects induced by stress and immunity and inflammation: mechanisms of communication. Front. Endocrinol. (Lausanne). 2025; 16: 1448750. https://doi.org/10.3389/fendo.2025.1448750
Об авторах
Дина Гумяровна ДиановаРоссия
Доктор мед. наук, ст. науч. сотр. отд. иммунобиологических методов диагностики ФБУН «ФНЦ МПТ УРЗН», 614045, Пермь, Россия
e-mail: dianovadina@rambler.ru
Олег Владимирович Долгих
Россия
Доктор мед. наук, зав. отд. иммунобиологических методов диагностики ФБУН «ФНЦ МПТ УРЗН», 614045, Пермь, Россия
e-mail: oleg@fcrisk.ru
Ольга Алексеевна Казакова
Россия
Канд. биол. наук, зав. лаб. иммуногенетики отд. иммунобиологических методов диагностики ФБУН «ФНЦ МПТ УРЗН», 614045, Пермь, Россия
e-mail: chakina2011@yandex.ru
Алиса Сергеевна Ширинкина
Россия
Науч. сотр. лаб. иммуногенетики отд. иммунобиологических методов диагностики ФБУН «ФНЦ МПТ УРЗН», 614045, Пермь, Россия
e-mail: shirinkina.ali@yandex.ru
Рецензия
Для цитирования:
Дианова Д.Г., Долгих О.В., Казакова О.А., Ширинкина А.С. Иммунный и генетический статус детей, проживающих в условиях аэрогенной экспозиции никелем. Гигиена и санитария. 2025;104(12):1721-1726. https://doi.org/10.47470/0016-9900-2025-104-12-1721-1726. EDN: ptnnbg
For citation:
Dianova D.G., Dolgih O.V., Kazakova O.A., Shirinkina A.S. Immune and genetic status in children residing in conditions of airogenic exposure to nickel. Hygiene and Sanitation. 2025;104(12):1721-1726. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1721-1726. EDN: ptnnbg
JATS XML









































