Перейти к:
Определение ацетальдегида в почве методом газовой хроматографии с пламенно-ионизационным детектором в сочетании со статическим парофазным анализом
https://doi.org/10.47470/0016-9900-2025-104-12-1772-1778
EDN: ibnkwh
Аннотация
Введение. Ацетальдегид представляет опасность для окружающей среды, поэтому его содержание регламентируется в воздухе, воде и почве. ПДК в почве установлен на уровне 10 мг/кг, однако нормативно-методические документы для определения этого вещества в почве отсутствуют.
Цель исследования – определение ацетальдегида в почве методом газовой хроматографии в сочетании со статическим парофазным анализом.
Материалы и методы. Для исследований использовали образцы дерново-подзолистой, песчаной, городской почв и чернозёма обыкновенного, отобранных в Московской, Курской, Мурманской и Тверской областях. Определение ацетальдегида проводили на аппаратно-программном комплексе на базе газового хроматографа «Хроматэк-Кристалл 5000.2» (ЗАО «Хроматэк», Россия) с пламенно-ионизационным детектором (ПИД) и внешним дозатором равновесного пара Lab Hut HT 200 H-200 (HTA s.r.l., Италия), с капиллярной колонкой DB-624 (Agilent, США) 60 м, 0,53 мм, 3 мкм.
Результаты. Изучен большой массив (более тысячи) образцов почв. Во всех пробах присутствовал ацетальдегид, концентрация которого колебалась от 0,04 до 6 мг/кг. Исследована зависимость сигнала пламенно-ионизационного детектора (ПИД) от массы пробы, её влажности, времени и температуры термостатирования. Установлено, что оптимальная масса навески при использовании флаконов вместимостью 20 мл составляет 2 г, а влажность пробы для большинства типов почв – 20%. Анализ образцов почвы по методу ЕРА 5021 с добавлением к 2 г почвы 10 см3 модифицирующего раствора или реагентной воды приводит к очень низким значениям площадей хроматографических пиков или их отсутствию. Извлечение ацетальдегида непосредственно из образца почвы позволяет увеличить чувствительность определения в 10–60 раз.
Ограничения исследования. Градуировочные графики, построенные с использованием различных типов почв, могут иметь разные угловые коэффициенты, поэтому с целью унификации целесообразно использовать водные растворы, хотя такой подход может вносить систематическую погрешность в результаты анализа.
Заключение. Разработан метод определения ацетальдегида в почве методом газовой хроматографии с пламенно-ионизационным детектором в сочетании со статическим парофазным анализом. Предел определения составил 0,04 мг/кг.
Соблюдение этических стандартов. Исследование не требует представления заключения комитета по биомедицинской этике или иных документов.
Участие авторов:
Некрасова Л.П. – концепция и дизайн исследования, проведение экспериментальных исследований, сбор материала и обработка данных, написание текста, редактирование;
Сбитнев А.В. – проведение экспериментальных исследований, сбор материала и обработка данных;
Филимонова Е.И. – проведение экспериментальных исследований, обработка результатов, статистический анализ;
Кулешова О.Ю. – проведение экспериментальных исследований, сбор материала и обработка данных;
Водянова М.А. – сбор материала, обработка результатов.
Все соавторы – утверждение окончательного варианта статьи, ответственность за целостность всех её частей.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Финансирование. Исследование выполнено в рамках государственного задания.
Поступила: 18.09.2025 / Поступила после доработки: 09.10.2025 / Принята к печати: 02.12.2025 / Опубликована: 15.01.2026
Ключевые слова
Для цитирования:
Некрасова Л.П., Сбитнев А.В., Филимонова Е.И., Кулешова О.Ю., Водянова М.А. Определение ацетальдегида в почве методом газовой хроматографии с пламенно-ионизационным детектором в сочетании со статическим парофазным анализом. Гигиена и санитария. 2025;104(12):1772-1778. https://doi.org/10.47470/0016-9900-2025-104-12-1772-1778. EDN: ibnkwh
For citation:
Nekrasova L.P., Sbitnev A.V., Filimonova E.I., Kuleshova O.J., Vodianova M.A. Determination of acetaldehyde in soil by gas chromatography with a flame ionization detector in combination with static headspace analysis. Hygiene and Sanitation. 2025;104(12):1772-1778. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1772-1778. EDN: ibnkwh
Введение
Ацетальдегид – второе соединение в гомологическом ряду альдегидов, бесцветная жидкость с резким запахом. Плотность 0,784 г/см³, температура плавления минус 123,37 °С, температура кипения – плюс 20,2 °С, давление паров при температуре плюс 20 °С – 98,7 кПа. Ацетальдегид относится к летучим органическим соединениям (ЛОС), хорошо растворяется в воде, спирте, эфире; умеренно токсичен, предельная концентрация в воздухе рабочей зоны составляет 5 мг/м³. Пары ацетальдегида при попадании на кожу и слизистые оболочки вызывают их поражение. LD50 для крыс при пероральном введении составляет 661 мг/кг массы тела [1]. Поскольку ацетальдегид представляет угрозу для окружающей среды, его концентрация в воде, воздухе и почве нормируется (табл. 1).

В соответствии с СанПин 1.2.3865–21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания» ПДК ацетальдегида в почве 10 мг/кг установлена по воздушно-миграционному показателю. На основании проведённых ранее исследований влияния ацетальдегида на светло-каштановую почву была обоснована ПДК ацетальдегида в почве по водно-миграционному показателю – 27 мг/кг [2]. Ацетальдегид не только используется в промышленности для получения ряда органических веществ и полимеров [3], но также довольно распространён в природе [4]: присутствует в продуктах растительного происхождения [5, 6], образуется в почве в результате деятельности микроорганизмов [7, 8]. Ацетальдегид присутствует в атмосферном воздухе, и его концентрация подвержена суточным колебаниям [9]. В результате бытовой деятельности человека в воздухе закрытых помещений образуется ацетальдегид, который относится к девяти приоритетным опасным загрязнителям среды обитания [10]. Ацетальдегид – продукт микробиологической трансформации в почвах и донных отложениях нефтяных углеводородов, углеводов и белковых веществ [11]. Высокие его концентрации действуют угнетающе на почвенных червей [12], а низкие стимулируют жизнедеятельность микробного сообщества [2].
Несмотря на то что установлена ПДК ацетальдегида в почве, нормативно-методические документы для его определения отсутствуют. Статический парофазный анализ (ПФА) является эффективным и робастным методом определения ЛОС в воде, почве, донных отложениях, отходах производства и потребления, биологических жидкостях и продуктах питания [13]. Наиболее эффективен этот метод для соединений, плохо растворимых в воде [14]. Показано, что использование ПФА для соединений с константной равновесия K = CL/CG (где CL – концентрация аналита в жидкости, CG – его концентрация в паровой фазе) менее 10 даёт существенный выигрыш в чувствительности определения [14]. Ацетальдегид относится к высоколетучим соединениям, при этом он хорошо растворим в воде. Константа равновесия для альдегидов и кетонов согласно [13] составляет 3 · 10² – 2 · 10³, что делает определение ацетальдегида методом ПФА проблематичным. Так, методика американского агентства по охране окружающей среды ЕРА 5021А включает 58 ЛОС [15], однако ацетальдегид в этом списке отсутствует. Обзор методов определения ЛОС в почвах представлен в работе [16], где показано, что в качестве пробоподготовки для определения водорастворимых ЛОС в почве рекомендуется азеотропная дистилляция – длительный, трудоёмкий метод. Авторами [17] предложена методика определения 52 ЛОС в воде, в том числе ацетальдегида, чувствительность определения которого на пламенно-ионизационном детекторе составила 30 мкг/дм³ [17]. С учётом этих данных можно предположить возможность определения ацетальдегида в почве методом ПФА.
Цель работы – разработать метод определения ацетальдегида методом газовой хроматографии на пламенно-ионизационном детекторе в сочетании со статическим парофазным анализом.
Материалы и методы
Оборудование. Для проведения исследований использовали аппаратно-программный комплекс для медицинских исследований на базе газового хроматографа «Хроматэк-Кристалл 5000.2» (ЗАО «Хроматэк», Россия) с пламенно-ионизационным детектором и внешним дозатором равновесного пара Lab Hut HT 200 H-200 (HTA s.r.l., Италия). Хроматографическое разделение проводили на капиллярной колонке Rtx 1701 (Restek, США) (60 м; 0,32 мм; 3 мкм) и DB-624 (Agilent, США) (60 м; 0,53 мм; 3 мкм). Программирование температуры осуществляли в режиме: плюс 45 °С (9 мин) – 5 °С/мин до температуры плюс 115 °С (7 мин) – 5 °С/мин до температуры плюс 135 °С (7 мин) – 10 °С/мин до температуры плюс 180 °С (14 мин) – 25 °С/мин до температуры плюс 220 °С (10 мин). Газ-носитель – азот, скорость потока – 4,9 мл/мин, температура испарителя – плюс 230 °С, температура детектора – плюс 280 °С. Определению не мешают другие соединения, поскольку хорошо разделяются на хроматографической колонке в условиях анализа (рис. 1). Параметры НТ-200: время кондиционирования составляло 25–50 мин, температура кондиционирования – плюс 80–90 °С, температура иглы – плюс 85–95 °С. Деионизированную воду получали на установке ICW-3000 System (Millipore Corporation, Франция).
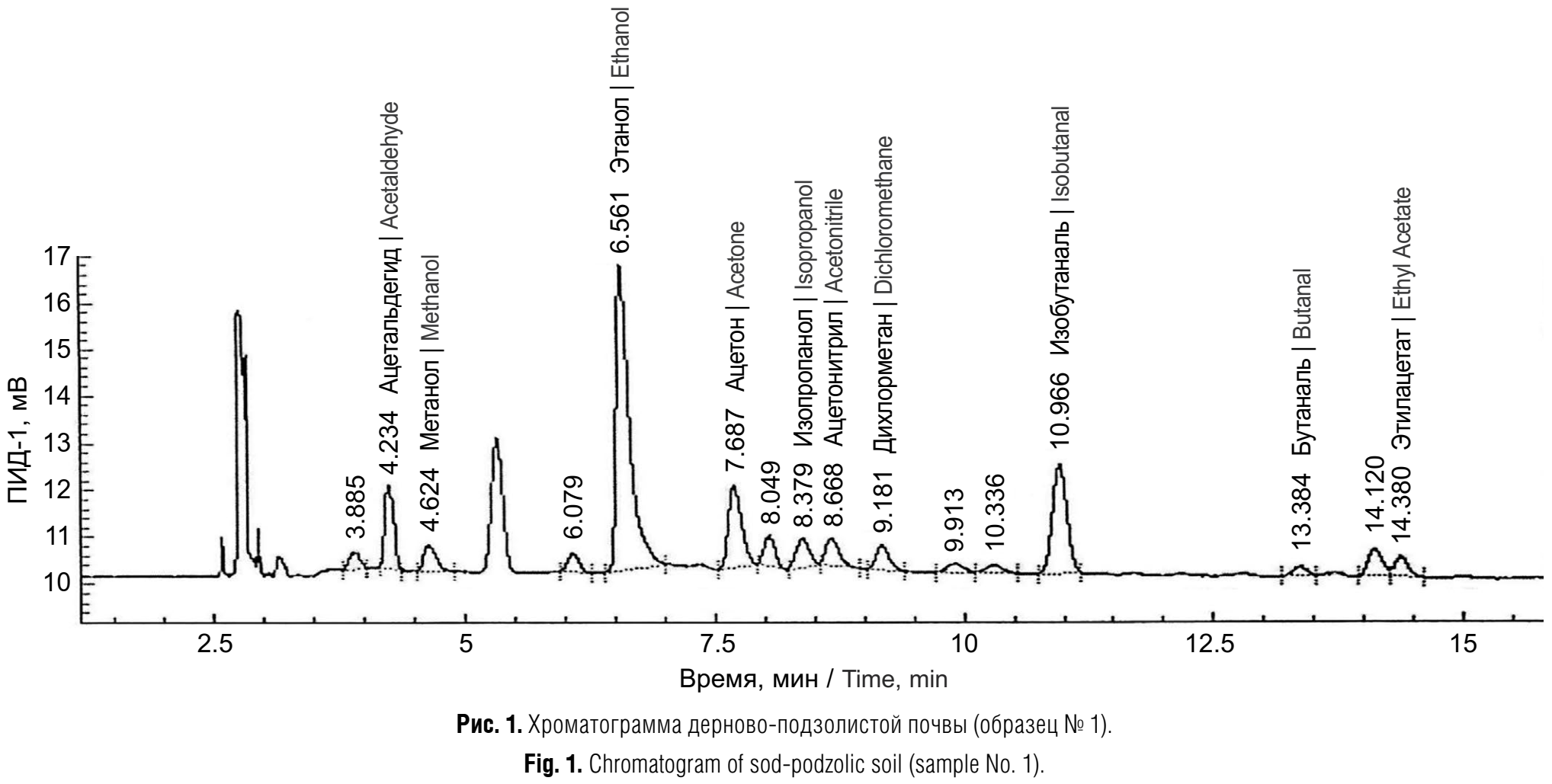
Объекты исследования. Для исследований использовали образцы дерново-подзолистой, песчаной, городской почв и чернозёма обыкновенного, отобранных в Московской, Курской и Тверской областях. Отбор проб осуществляли в соответствии с ГОСТ ISO 14507–2015 «Качество почвы. Предварительная подготовка проб для определения органических загрязняющих веществ». Анализировали пробы естественной влажности. Значение влажности определяли в отдельной порции пробы. Для проведения модельных экспериментов пробы сушили на воздухе, удаляли остатки растений, измельчали в фарфоровой ступке и просеивали через сито 1–2 мм. Высушенные пробы хранили в банках с завинчивающимися крышками. Для исследования зависимости чувствительности определения от влажности образцы подготавливали следующим образом: почву массой 20 г увлажняли до требуемой влажности, затем во флаконы для ПФА отбирали навески по 2 г, либо навеску сухой почвы массой 2 г увлажняли до необходимой влажности соответствующим объёмом деионизированной воды, либо добавляли 10 мл модифицирующего раствора или 10 мл деионизированной воды. Модифицирующий раствор готовили в соответствии с ЕРА 5021A [15]. Статистическую обработку результатов проводили в программе Microsoft Excel, доверительный интервал средних значений рассчитывали по критерию Стьюдента для вероятности 95%.
Реактивы. Ацетальдегид для хроматографии (ХромЛаб, Россия), кислота ортофосфорная х.ч., 87% («Компонент-реактив», Россия), хлорид натрия х.ч., («Компонент-реактив», Россия), песок белый кварцевый, фракция 0,2–0,4 мм, не содержащий ЛОС («Аквафильтр», Россия), деионизированная вода, полученная на установке ICW-3000 System.
Результаты
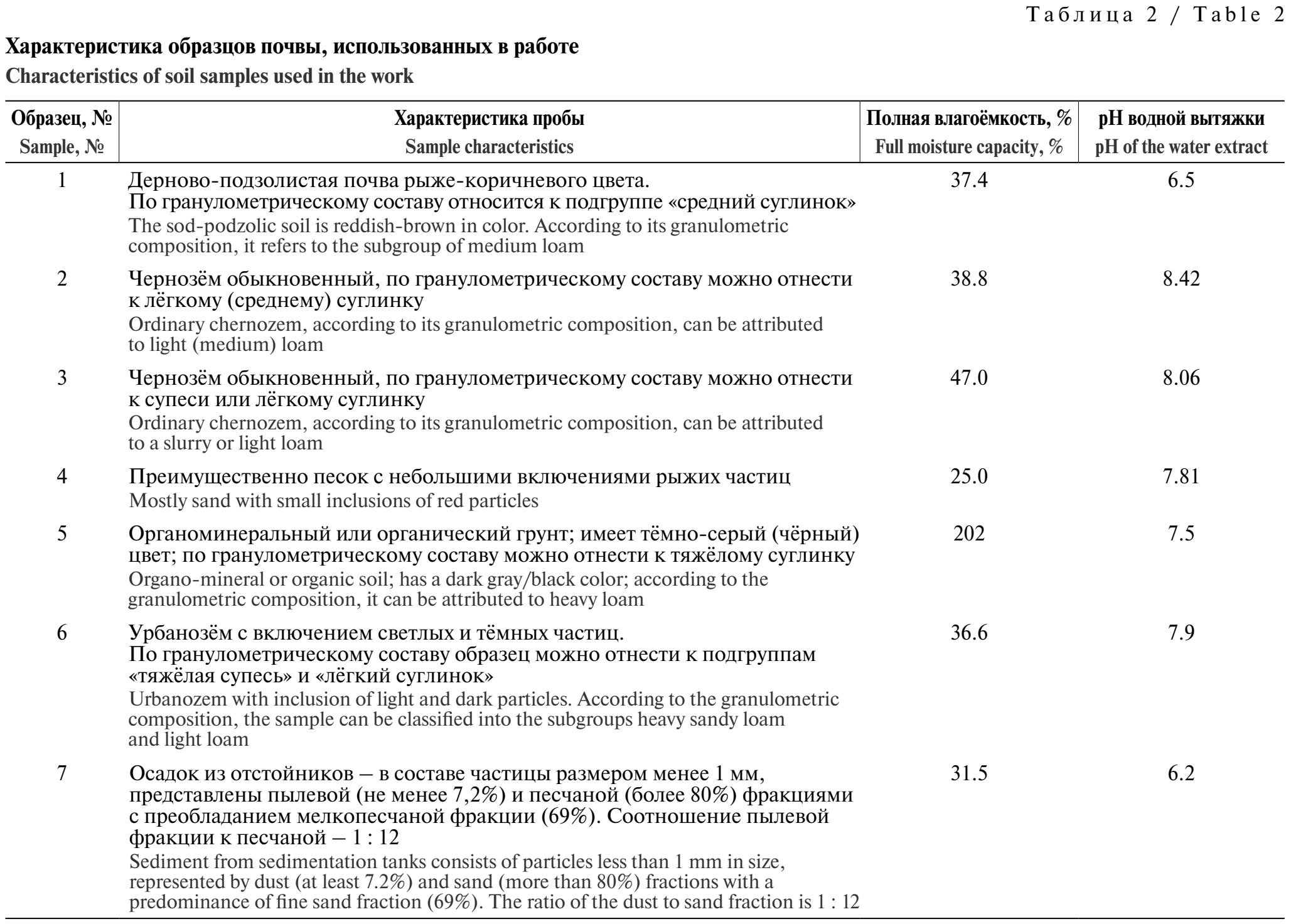
Характеристика объектов исследования. Описание образцов и их характеристики представлены в табл. 2. Исследования зависимости площади пика от влажности, массы навески и условий термостатирования проводили, не вводя в образцы почвы дополнительных порций ацетальдегида. Градуировочные графики строили, используя белый кварцевый песок и образец № 7, содержащий следовые количества ацетальдегида.
Зависимость площади пика от массы навески (высоты слоя почвы). Можно было предположить, что увеличение навески почвы должно привести к увеличению чувствительности определения как за счёт увеличения массы ацетальдегида, так и за счёт уменьшения объёма газовой фазы. Для определения зависимости площади пика от массы навеску высушенной пробы, содержащей ацетальдегид, массой 0,5–3 г помещали в хроматографическую виалу вместимостью 20 мл, герметично укупоривали и устанавливали на автосамплер парофазного дозатора. Если масса навески почвы находилась в пределах 0,5–2 г (2,5 г в зависимости от плотности почвы), наблюдалась линейная зависимость площади пика ацетальдегида от массы почвы. Дальнейшее увеличение массы навески и соответственно высоты слоя почвы нарушало пропорциональность площади пика (S) от массы анализируемого образца (m) и приводило к уменьшению площади пика при увеличении массы образца. Вероятно, этот эффект связан с тем, что увеличение высоты слоя почвы затрудняло диффузию ацетальдегида в газовую фазу либо приводило к его вторичному поглощению верхними слоями почвы. Такая зависимость наблюдалась как для высушенной, так и для увлажнённой почвы. Из данных эксперимента можно полагать, что оптимальная масса навески составляла 2 г. С учётом данного обстоятельства, а также того, что зарубежные методики определения ЛОС методом статического парофазного анализа с использованием флаконов вместимостью 20 мл используют навеску массой 2 г, все модельные эксперименты проводили с такой массой пробы.
Зависимость площади пика от влажности почвы. Поскольку ЛОС чрезвычайно летучи, в соответствии с ГОСТ ISO 14507–2015 они должны быть определены в отобранных образцах максимально быстро. При этом пробы почвы могут содержать различное количество влаги, которое для пересчёта содержания ЛОС на сухую почву определяется в отдельном анализе. Представляло интерес определение влияния влажности почвы на площади пиков ацетальдегида. Для этого проводили следующий модельный эксперимент. При определении зависимости площади пика от влажности почвы навеску массой 2 г помещали в хроматографическую виалу (флакон) вместимостью 20 мл для ПФА, добавляли деионизированную воду для создания требуемой влажности, герметично укупоривали, перемешивали и давали системе равномерно увлажниться в течение часа. Затем флакон устанавливали на автосамплер парофазного дозатора НТ-200. Все измерения проводили в трёх повторностях.
Для разных типов почв зависимости площади пика от влажности почвы имели отличия, которые в значительной степени определялись полной влагоёмкостью почвы. Как правило, такая зависимость в большинстве случаев имела максимум, который приходился на почву 20–30%-й влажности, если её полная влагоёмкость не превышала 50% (рис. 2). Для органоминерального грунта (образец № 5) вплоть до 100%-й влажности наблюдалось увеличение сигнала детектора, но уже при 120%-й влажности происходило его резкое падение.
Сравнение площадей пиков ацетальдегида при различных способах подготовки образца представлены в табл. 3, из которой отчётливо видно, что добавление к пробе почвы 10 мл деионизированной воды или модифицирующего раствора, как это делается при определении большого числа ЛОС [15], плохо подходит для определения ацетальдегида в пробах почвы. Более всего это относится к образцам чернозёма (соотношение площадей 61,4; 39,8; 20,7), а менее всего – к песчаной почве.

Зависимость площади пика от условий термостатирования. Изменение температуры термостатирования в парофазном дозаторе с плюс 80 до плюс 90 °С при неизменном времени термостатирования приводило к увеличению площади пика в среднем на 26%. Было изучено влияние времени термостатирования на площади пика ацетальдегида. Наряду с термостатированием в парофазном дозаторе увлажнённые пробы помещали на 1 ч в сушильный шкаф при температуре плюс 90 °С. При этом площадь пика ацетальдегида увеличивалась на 35–90%.
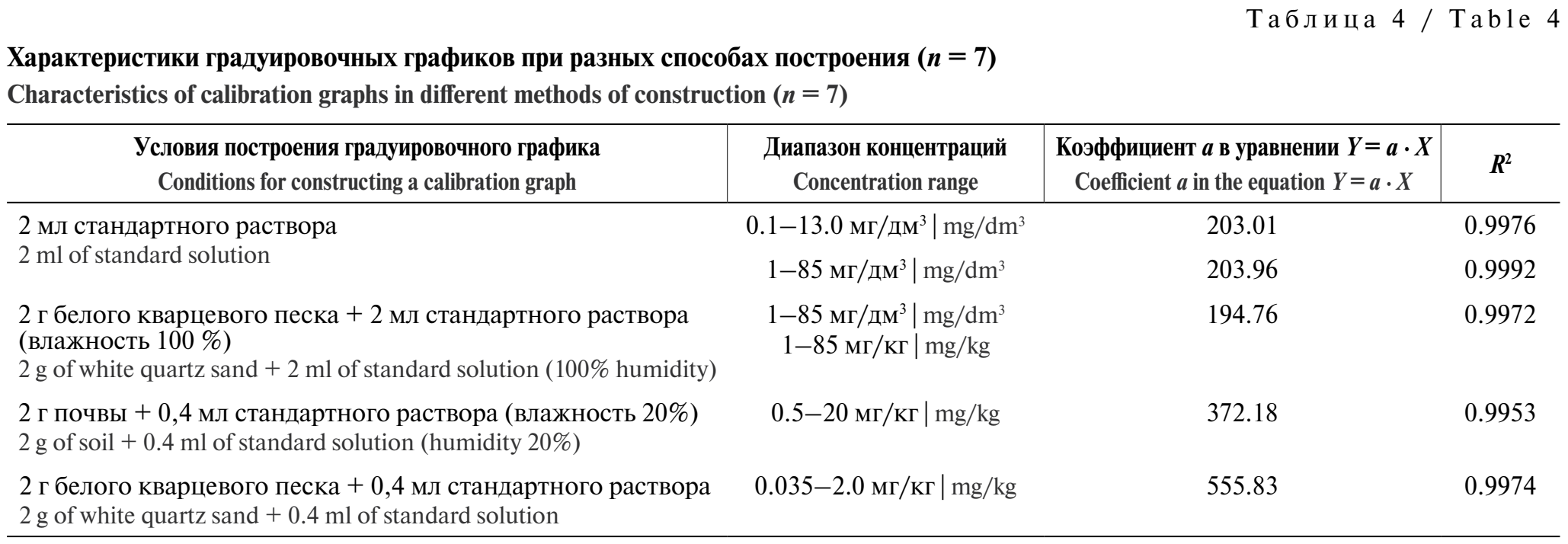
Построение калибровочного графика. Градуировочный график строили разными способами: с использованием 2 мл стандартного раствора ацетальдегида заданной концентрации, 2 г белого кварцевого песка, не содержащего ацетальдегида, с добавлением 2 мл стандартного раствора ацетальдегида заданной концентрации, а также путём внесения в 2 г почвы заданного количества ацетальдегида и с помощью внесения в 2 г кварцевого песка заданного количества ацетальдегида (табл. 4). Для построения калибровочного графика был выбран образец почвы, содержащий минимальное количество ЛОС, которое определяли в исходной пробе. Поскольку для преобладающего числа различных почв влажность 20% является предпочтительной при проведении анализа, график строили в условиях 20%-й влажности, добавляя к образцу почвы, высушенному в условиях чистого помещения, 0,4 мл раствора ацетальдегида в воде заданной концентрации (см. табл. 4).
Определение содержания ацетальдегида в натурных образцах почвы. Для оценки содержания ацетальдегида в образцах почвы применяли градуировочный график, построенный с использованием 2 мл стандартного раствора ацетальдегида в воде. Образцы почвы для анализа отбирали на территориях городских и сельских поселений, парковых зон, лесных массивов, на полигонах твёрдых бытовых отходов (ТБО), вблизи промышленных предприятий, железнодорожных путей и у водоёмов. Во всех исследованных образцах присутствовал ацетальдегид. Значимых закономерностей содержания ацетальдегида от характера территории выявлено не было (такая задача в данной работе и не ставилась). В пробах, отобранных на территории Курской (г. Курчатов), Московской областей и в г. Железногорске Красноярского края содержание ацетальдегида было в среднем выше, чем в г. Яровое Алтайского края и населённых пунктах Мурманской области. Максимальная концентрация ацетальдегида была зафиксирована на очистных сооружениях в г. Железногорске (9,8 мг/кг). Повышенные по сравнению с другими территориями концентрации ацетальдегида отмечались в парковых зонах – в пределах 2–2,5 мг/кг. Также отдельные высокие значения были выявлены на полигоне ТБО в г. Яровое: 4,5–5 мг/кг.
Обсуждение
Методики определения ЛОС американского Агентства по охране окружающей среды ЕРА предлагают различные подходы к детектированию ЛОС и способы пробоподготовки почвенных образцов [18–22]. Наиболее полную информацию об определении 131 ЛОС содержит ЕРА 8260 [18], где отмечена низкая чувствительность определения спиртов и альдегидов при использовании парофазного анализа (статического и динамического вариантов) в условиях анализа 2 г почвы с добавлением 10 мл модифицирующего раствора. Известно, что выигрыш в чувствительности определения ЛОС в водных пробах тем выше, чем меньше K = CL/CG [14]. В случае почвенных образцов с добавлением водной фазы получаем тройную систему «твёрдая фаза – жидкость – газ». При этом в газообразную фазу целевой аналит попадает в результате перехода сначала в жидкую, а затем в газообразную фазу. При этом известно, что коэффициент распределения для ацетальдегида имеет высокое значение, то есть низкую чувствительность при определении из водного раствора, в то же время эффективность его извлечения из твёрдой матрицы может быть выше, чем из жидкой, что подтверждается экспериментальными результатами, полученными в данной работе.
Влияние параметров пробоподготовки на эффективность определения ЛОС рассматривалось в работах [23–25]. В [25] были изучены факторы, влияющие на чувствительность определения керосинов в почвах. Показано, что высокая влажность образца резко снижает чувствительность определения аналитов. Результаты этого исследования сходны с выводами, полученными в данной работе, хотя в них изучались соединения, относящиеся к различным классам. В то же время работы [23, 24] демонстрируют иные закономерности для ароматических и галогенсодержащих углеводородов.
Заключение
Разработан газохроматографический метод равновесной паровой фазы для определения ацетальдегида в почве. Установлены оптимальные параметры пробоподготовки: масса навески 2 г, влажность образца 20%, температура термостатирования плюс 90 °С, время термостатирования 50 мин. Предел определения составил 0,04 мг/кг, СКО – 24%. Определению не мешают другие соединения, поскольку хорошо разделяются на хроматографической колонке в условиях анализа.
Список литературы
1. National Center for Biotechnology Information. PubChem Compound Summary for CID 177, Acetaldehyde. Available at: https://pubchem.ncbi.nlm.nih.gov/compound/Acetaldehyde
2. Сергиенко Л.И. Материалы к обоснованию предельно допустимой концентрации ацетальдегида в почве. Гигиена и санитария. 1984; 63(2): 69–72.
3. Кнунянц И.Л., ред. Химическая энциклопедия. М.: Советская энциклопедия; 1988.
4. Jardine K., Harley P., Karl T., Guenther A., Lerdau M., Mak J.E. Plant physiological and environmental controls over the exchange of acetaldehyde between forest canopies and the atmosphere. Biogeosciences. 2008; 5(6): 1559–72. https://doi.org/10.5194/bg-5-1559-2008
5. Brancato A., Lavanco G., Cavallaro A., Plescia F., Cannizzaro C. Acetaldehyde, motivation and stress: behavioral evidence of an addictive ménage à trois. Front. Behav. Neurosci. 2017; 11: 23. https://doi.org/10.3389/fnbeh.2017.00023
6. Pesis E. The role of the anaerobic metabolites, acetaldehyde and ethanol, in fruit ripening, enhancement of fruit quality and fruit deterioration. Postharvest Biol. Technol. 2005; 37: 1–19. https://doi.org/10.1016/j.postharvbio.2005.03.001
7. Monard C., Caudal J.P., Cluzeau D., Le Garres J.L., Hellequin E., Hoeffer K., et. al. Short-term temporal dynamics of VOC emissions by soil systems in different biotopes. Front. Environ. Sci. 2021; 9: 650701. https://doi.org/10.3389/fenvs.2021.650701
8. Mancuso S., Taiti C., Bazihizina N., Costa C., Menesatti P., Giagnoni L., et al. Soil volatile analysis by proton transfer reaction-time of flight mass spectrometry (PTR-TOF-MS). Appl. Soil Ecol. 2015; 86: 182–91. https://doi.org/10.1016/j.apsoil.2014.10.018
9. Panday R., Bhatt P.S., Tribikram Bhattarai T., Shakya K., Sreerama L. Seasonal and diurnal concentrations of ambient formaldehyde and acetaldehyde in Bangkok. BMC Res. Notes. 2016; 9: 491. https://doi.org/10.1186/s13104-016-2297-7
10. Salthammer T. Acetaldehyde in the indoor environment. Environ. Sci. Atmos. 2023; 3(3): 474–93. https://doi.org/10.1039/D2EA00146B https://elibrary.ru/otbgan
11. Гаретова Л.А., Фишер Н.К., Имранова Е.Л., Кириенко О.А., Кошельков А.М. Особенности формирования органических соединений в грунтах и донных отложениях промзоны г. Хабаровск. Геохимия. 2021; 66(5): 464–72. https://doi.org/10.31857/S0016752521030055 https://elibrary.ru/disisq
12. Калинникова Т.Б., Тимошенко А.Х., Колсанова Р.Р., Захаров С.В., Гайнутдинов М.Х., Шагидуллин Р.Р. Действие ацетальдегида на организмы свободноживущих почвенных нематод Caenorhabditis elegans линий N2 и IPE1. Токсикологический вестник. 2012; (4): 45–8. https://elibrary.ru/tqunzl
13. Родинков О.В. Современные тенденции развития парофазного газохроматографического анализа. Аналитика. 2021; (1): 30–9. https://doi.org/10.22184/2227-572X.2021.11.1.30.39 https://elibrary.ru/dlugcc
14. Витенберг А.Г. Статический парофазный анализ. Физико-химические основы и области применения. Российский химический журнал. 2003; 47(1): 7–22.
15. Method 5021. A volatile organic Compounds in various Sample Matrices using equilibrium Headspace Analysis; 2014. Available at: https://epa.gov/sites/default/files/2015-12/documents/5021a.pdf
16. Некрасова Л.П. Определение летучих органических соединений в почвах газохроматографическим методом. Обзор литературы. Гигиена и санитария. 2024; 103(10): 1149–54. https://doi.org/10.47470/0016-9900-2024-103-10-1149-1154 https://elibrary.ru/odtblm
17. Сотников Е.Е., Загайнов В.Ф., Михайлова Р.И., Милочкин Д.А., Рыжова И.Н., Корнилов И.О. Парофазный анализ летучих органических соединений в питьевой воде методом газовой хроматографии. Гигиена и санитария. 2014; 93(2): 92–6. https://elibrary.ru/sbkjlz
18. Method 8260D. Volatile Organic Compounds by Gas Chromatography/Mass Spectrometry; 2017. Available at: https://epa.gov/sites/default/files/2017-04/documents/method_8260d_update_vi_ final_03-13-2017.pdf
19. Method 5030C. Purge-and-Trap for aqueous Samples. Revision 3 May 2003. EPA Method 5030C (SW-846): Purge-and-Trap for Aqueous Samples. Available at: https://epa.gov/sites/default/files/2015-07/documents/epa-5030c.pdf
20. Method 5031 volatile, nonpurgeable water-soluble Compounds by azeotropic Distillation. Revision, 1996. Method 5031: Volatile, Nonpurgeable, Water-Soluble Compounds by Azeotropic Distillation, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods. Available at: https://epa.gov/sites/default/files/2015-12/documents/5031.pdf
21. Method 5032 volatile organic Compounds by Vacuum Distillation. Revision 0 December 1996. Method 5032: Volatile Organic Compounds by Vacuum Distillation, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods. Available at: https://epa.gov/sites/default/files/2015-12/documents/5032.pdf
22. Method 5035 Closed-System Purge-and-Trap and Extraction for volatile organics in Soil and Waste Samples. Revision, 1996. Method 5035: Closed-System Purge-and-Trap and Extraction for Volatile Organics in Soil and Waste Samples, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods. Available at: https://epa.gov/sites/default/files/2015-12/ documents/5035.pdf
23. Галактионова Е.Б., Сафарова В.И., Теплова Г.И., Кудашева Ф.Х. Оптимизация условий извлечения и определения летучих органических соединений в донных отложениях методом статического парофазного анализа в сочетании с хромато-масс-спектрометрией. Вестник Башкирского университета. Раздел химия. 2009; 14(1): 68–71. https://elibrary.ru/klttzz
24. Галактионова Е.Б., Сафарова В.И., Кудашева Ф.Х., Теплова Г.И. Определение летучих органических соединений в донных отложениях методом хромато-масс-спектрометрии в сочетании со статическим парофазным анализом. Журнал аналитической химии. 2012; 67(6): 613–8. https://elibrary.ru/oxxpyz
25. Болотник Т.А., Смоленков А.Д., Смирнов Р.С., Шпигун О.А. Определение ракетных керосинов в почвах методом статического парофазного анализа в сочетании с газовой хромато-масс-спектрометрией. Вестник Московского университета. Серия 2: Химия. 2015; 56(4): 212–20. https://elibrary.ru/uduobv
Об авторах
Лариса Петровна НекрасоваРоссия
Канд. хим. наук, вед. науч. сотр. отд. физико-химических исследований и экотоксикологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: LNekrasova@cspmz.ru
Антон Владиславович Сбитнев
Россия
Науч. сотр. отд. физико-химических исследований и экотоксикологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: ASbitnev@cspfmba.ru
Екатерина Игоревна Филимонова
Россия
Химик отд. физико-химических исследований и экотоксикологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: EFilimonova@cspfmba.ru
Оксана Юрьевна Кулешова
Россия
Вед. специалист отд. физико-химических исследований и экотоксикологии ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: OKuleshova@cspmz.ru
Мария Александровна Водянова
Россия
Канд. биол. наук, учёный секретарь ФГБУ «ЦСП» ФМБА России, 119121, Москва, Россия
e-mail: MVodyanova@cspfmba.ru
Рецензия
Для цитирования:
Некрасова Л.П., Сбитнев А.В., Филимонова Е.И., Кулешова О.Ю., Водянова М.А. Определение ацетальдегида в почве методом газовой хроматографии с пламенно-ионизационным детектором в сочетании со статическим парофазным анализом. Гигиена и санитария. 2025;104(12):1772-1778. https://doi.org/10.47470/0016-9900-2025-104-12-1772-1778. EDN: ibnkwh
For citation:
Nekrasova L.P., Sbitnev A.V., Filimonova E.I., Kuleshova O.J., Vodianova M.A. Determination of acetaldehyde in soil by gas chromatography with a flame ionization detector in combination with static headspace analysis. Hygiene and Sanitation. 2025;104(12):1772-1778. (In Russ.) https://doi.org/10.47470/0016-9900-2025-104-12-1772-1778. EDN: ibnkwh
JATS XML









































